文獻解讀
文獻解讀|Oncogene 人肝癌腫瘤周圍微環境的蛋白質組學特征
腫瘤微環境(TME,tumor microenvironment)是液體、免疫細胞及包裹腫瘤的血管所組成的混合體,在腫瘤發生中起著重要作用,而TME參與初始腫瘤發生,腫瘤復發以及手術后轉移相關的過程尚不清楚。目前人類對癌癥轉移的研究也從未停止過,癌細胞像種子一樣可以四處傳播,而癌癥的擴散和生長很依賴周圍的“微環境”。2022年3月 Oncogene在線一篇“The proteomic characterization of the peritumor microenvironment in human hepatocellular carcinoma”的研究論文。在這項研究中,研究者提出了一個新概念,即PME (peritumor microenvironment)腫瘤周圍微環境,PME包括非常接近 “為腫瘤細胞生長提供合適環境的非腫瘤組織” 的周圍組織,腫瘤的發生、復發和轉移主要取決于PME。PME和TME均可影響腫瘤的進展,但目前為止很少有研究關注PME。該研究針對正常人肝組織和肝細胞癌 (HCC)腫瘤周圍組織(PEM)進行了首次蛋白質組學研究,分析確定了三種具有不同 HCC 特征的 PME 亞型,同時PME 的蛋白質組學特征表明,HCC發生和進展的整個過程存在很大差異,這些發現可以推動癌癥生物學、診斷和治療方面的進步。
材料方法
? 收集肝組織通過Q-Exactive HF LC-MS/MS進行分析;
? 生信分析識別正常肝組織和腫瘤周圍組織之間的差異表達蛋白;
? 聚類分析得到PEM蛋白質組的分子亞型,評估和檢驗亞型功效及其與臨床特征之間的關系;
? 腫瘤周圍組織的差異蛋白質組進行通路富集分析;
? PME-O(PME for occurrence) 和 PME-P(PME for progression)蛋白組學特征分析;
? 基于PME的藥物靶點發現與驗證。
研究
1. 肝癌患者PME的蛋白質組學結果分析
該研究在瘤周微環境(PME)中總共鑒定了6947蛋白, PME 和對照組比較發現1360 種差異表達的蛋白質(圖 1C、D)。富集分析表明這些差異蛋白質可能與 HCC 的發生和進展有關信號通路相關(圖 1E),其中糖酵解途徑中的關鍵調節蛋白表達顯著上調(圖 1F-P),表明肝特異性代謝途徑在 HCC 的 PME 中發生新的變化。
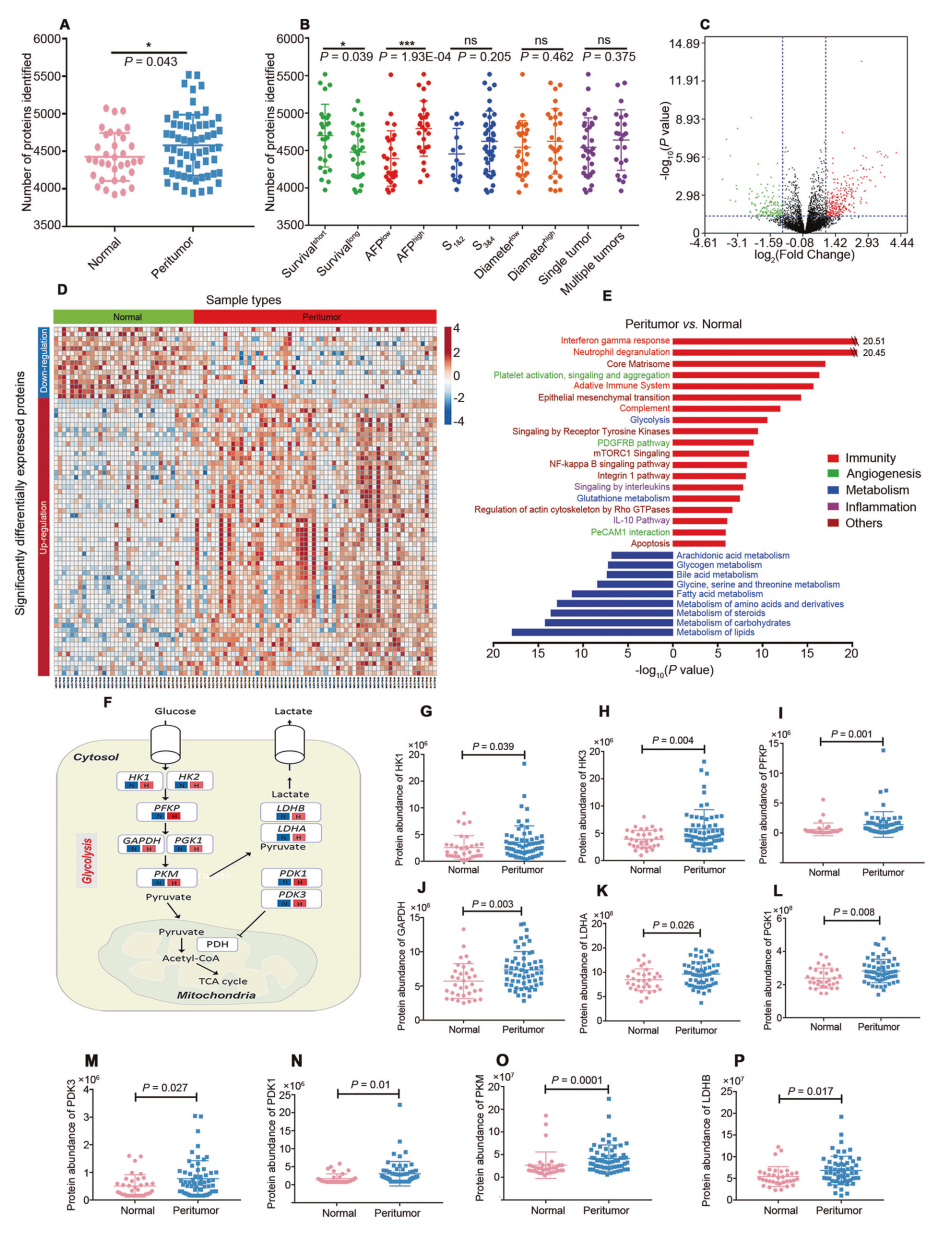
圖1 肝癌患者PME的蛋白質組學分析總結
2. 預測建模分析HCC在PEM-O和PEM-P中的發生進展
研究人員首先通過分析多個綜合因素發現免疫的 RI (風險指數)為 43.56,在六個因素中最高,其次是炎癥(33.78)和血管生成(26.82)(圖 2F)。接著對40種蛋白質進一步優化篩選。使用邏輯回歸方法,構建了一個發生預測模型,對三種蛋白質標志物(免疫蛋白 HSPA4L;炎癥蛋白 VIL1;和血管生成蛋白 TYMP)進行數據集和驗證數據集分析,表明基于PME 建立的模型在此研究可能對預測 HCC 發生的風險具有很高的價值。
在這項研究中,每位患者的HCC進展由不同的因素決定,炎癥、血管生成和代謝是PME中HCC進展的主要影響因素,這三個因素都有助于HCC進展。研究人員構建了一個進展預測模型,涉及三個蛋白質的標志物(炎癥蛋白 CMPK2;血管生成蛋白 TYMP;代謝蛋白 NADSYN1)(圖 S3C-I)。通過數據集和驗證數據集分析表明基于本研究中 PME 的發現建立的模型對于預測 HCC 進展的風險可能是有價值的。
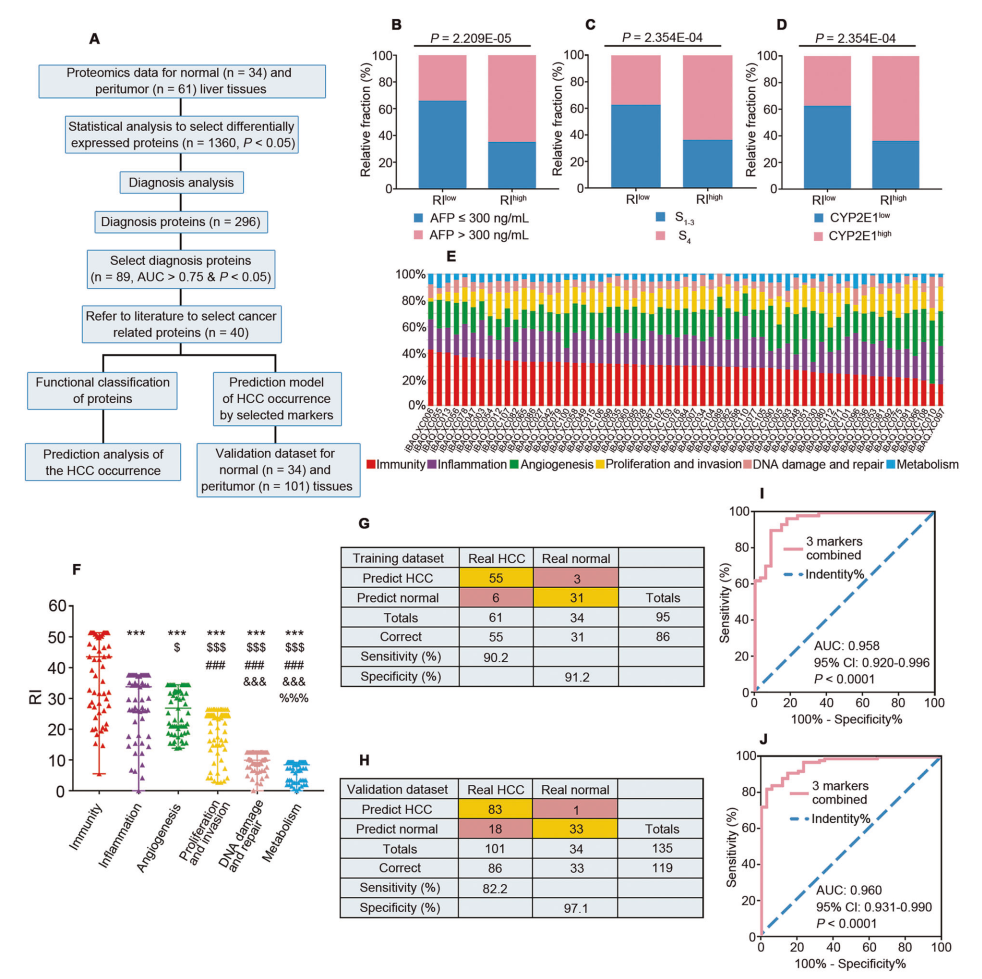
圖2 肝癌發生危險因素的預測評估
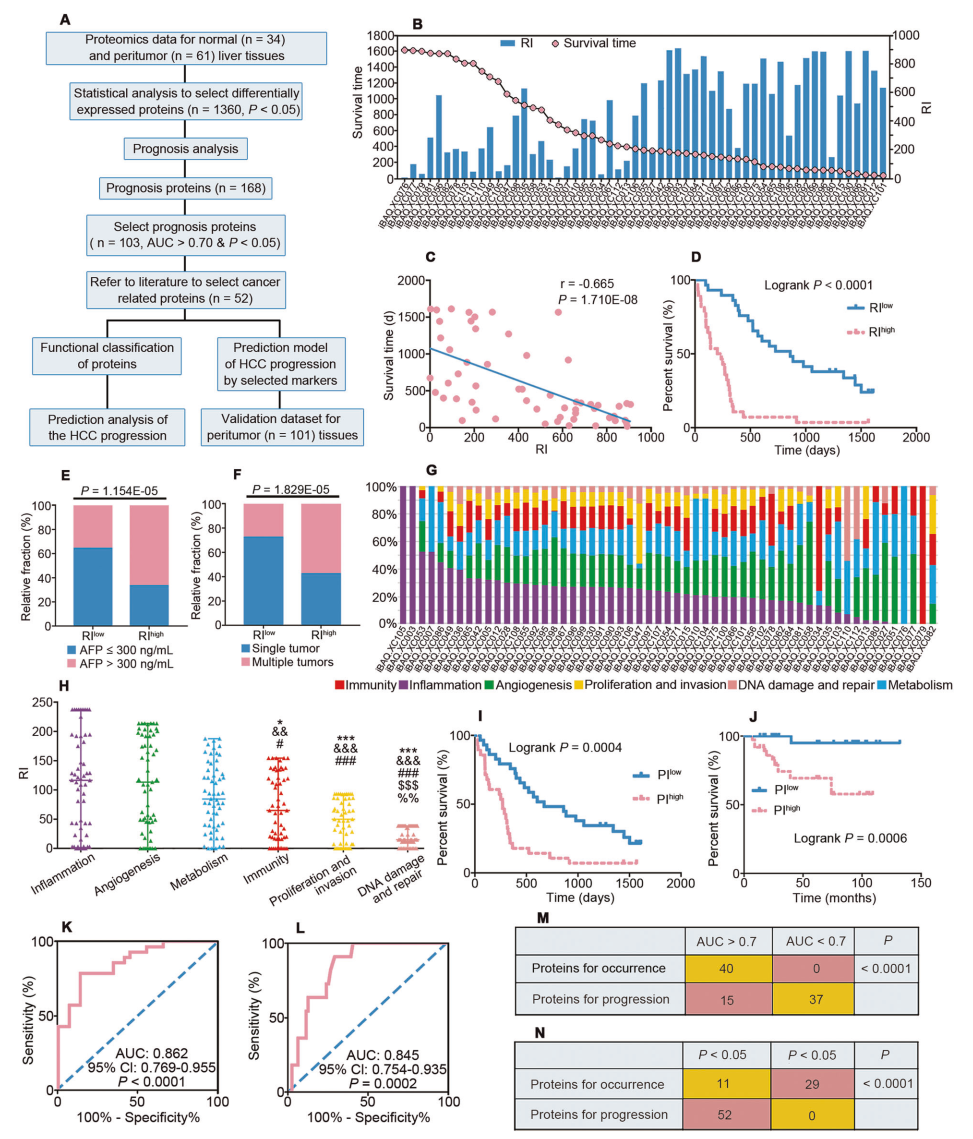
圖3 預測評估 HCC 進展的風險知數
3. HCC PME 亞型的特征
PME-O和PME-P分別由40和52個與疾病發生和進展高度相關的蛋白質組成,構成HCC PME,PME-O和PME-P的蛋白質在組成和功能上是不同的,這意味著肝癌的發生和發展是完全不同的階段,需要不同的預防和治療策略。該研究中,腫瘤分類首次基于 PME 而不是 TME,從而可以考慮發生和發展的整個過程。基于差異表達的蛋白質鑒定了三種蛋白質組亞型,所有病例均分為三個亞型,分別有 18、23 和 16 例被分類為 S-I、S-II 和 S-III 亞型(圖 4A)。在HCC的分子亞型的蛋白質的 RI 存在顯著差異:S-I、S-II和S-III亞型對PME-O的免疫(43.49、39.86和32.86)和PME-P的血管生成(89.51、127.19和162.31)表現出顯著差異(圖 4C,D)。CYP2E1 活性(1341.44 pmol/min/mg 蛋白、1370.02 pmol/min/mg 蛋白和 1700.58 pmol/min/mg 蛋白)也發現了三種亞型之間的顯著差異(圖 4E)。三個亞型 (圖4F-U) 之間在RI處具有顯著差異的16個蛋白質中,可以將10個蛋白質視為潛在的靶標 (圖4v),這表明PME中的三個亞型的特征明顯不同,因此需要不同的治療策略。
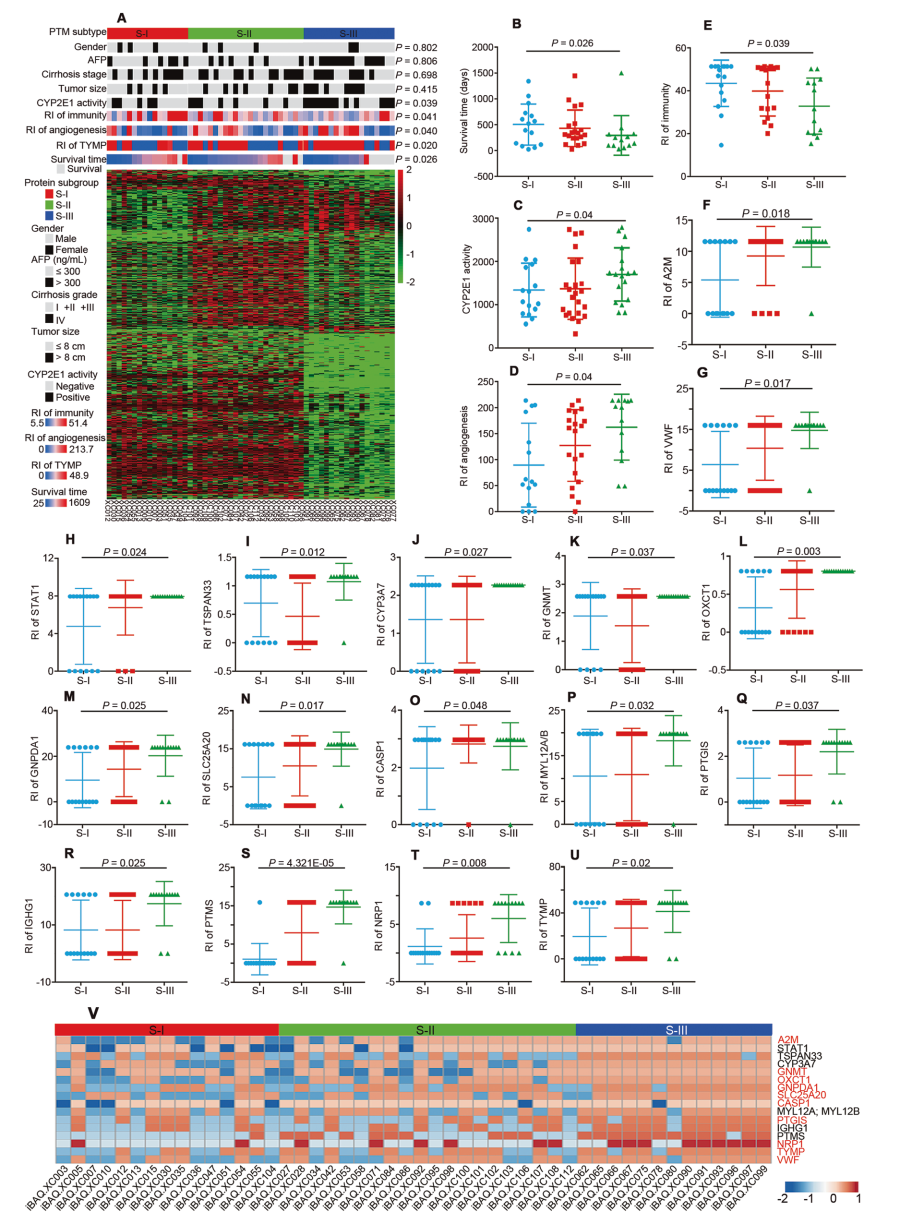
圖4 基于HCC PME的分子分型
4. TYMP是HCC的潛在靶點
TYMP(胸苷磷酸化酶)是肝癌潛在的抗血管生成靶標,TYMP表達與診斷(圖 5B)、預后(圖 5C)以及臨床參數(圖 5D-K)顯著相關。此外,研究人員發現 TYMP 與 PECAM1(圖 5L-O)顯著相關,而PECAM1 是 PME 中上調的微血管密度指標,與腫瘤大小和預后呈正相關(圖 5P)。
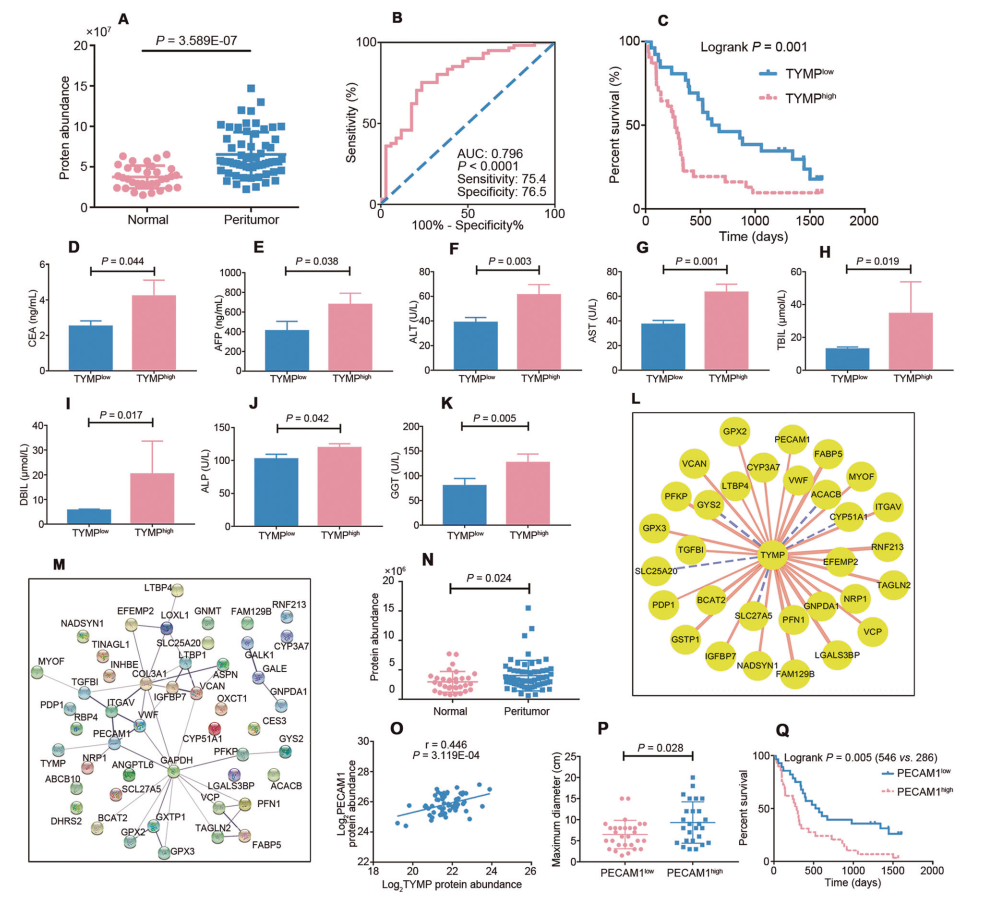
圖5 TYMP表達與臨床參數的關系及相互作用蛋白的篩選
目前Tipiracil (TPI) 是最有前途的 TYMP 抑制劑之一,而TPI在HCC中的抗血管生成作用尚未見報道。另一種TYMP抑制劑5'-O-三苯甲基肌苷(Kin59)在體外也顯示出抗血管生成作用,研究人員將 H22小鼠HCC細胞系用于移植BALB/c小鼠,后續研究中發現兩種TYMP抑制劑治療在不同程度上降低了腫瘤重量(圖6A-D),但它們對體重沒有顯著影響(圖6E)。同時,兩種TYMP抑制劑也減少了腫瘤內的新生血管(圖6F,G),顯然,抑瘤效果明顯與TYMP抑制劑的抗血管生成能力有關。此外TPI 分別在 24 小時和 48 小時對H22 細胞的體外生長和增殖沒有顯著影響,表明該抑制劑靶向腫瘤微環境而不是腫瘤細胞(圖 6H)。
以上結果表明TYMP可以作為肝癌的抗血管生成靶點,為進一步研究TYMP在肝癌血管生成中的機制,分析了血管生成中兩種常見且不同的信號通路。參與MAPK1 (ERK2)/RSK1/NF-kB通路的蛋白表達水平顯著上調,蛋白豐度的升高與TYMP的表達水平相關。隨著TYMP抑制劑的治療,MAPK1 (ERK2)/RSK1/NF-kB通路的mRNA被下調,與常見的血管生成相關蛋白VEGF和HIF1一致 (圖6I),表明TYMP上調通過MAPK1 (ERK2)/RSK1/NF-kB促進新血管形成途徑(圖 6J)。
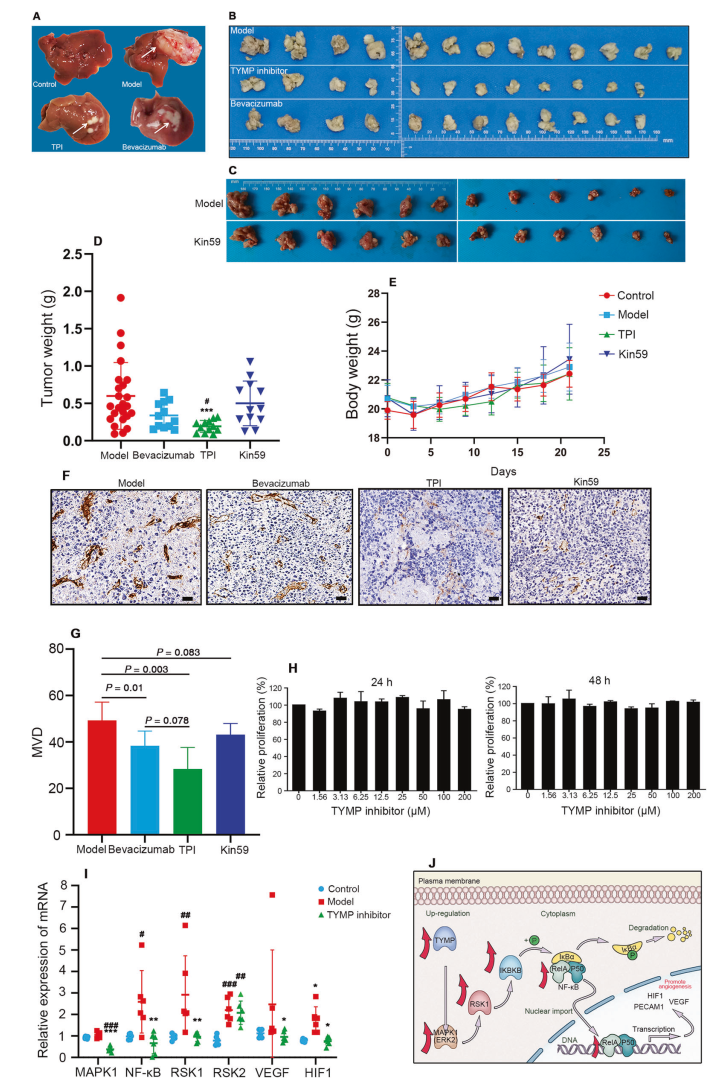
圖6 TYMP是肝癌潛在的抗血管生成靶標
小結
總之,在這項研究中提出了一個新概念:PME。PME涉及HCC發生和進展的整個過程,而TME只與進展有關。該研究結果表明,在蛋白質組的組成和功能方面,發生和進展的過程存在顯著差異,表明在不同的疾病階段需要不同的HCC預防和治療策略。研究人員還提出了一種新的基于PME的肝癌分類方法,這種分類可以更準確地反映HCC的多種特征,HCC中PME的信息可以促進癌癥的新進展。
三黍項目推薦




