文獻解讀 | 多組學+腸道菌群,中藥方劑項目申請思路+驗證其實沒那么難!

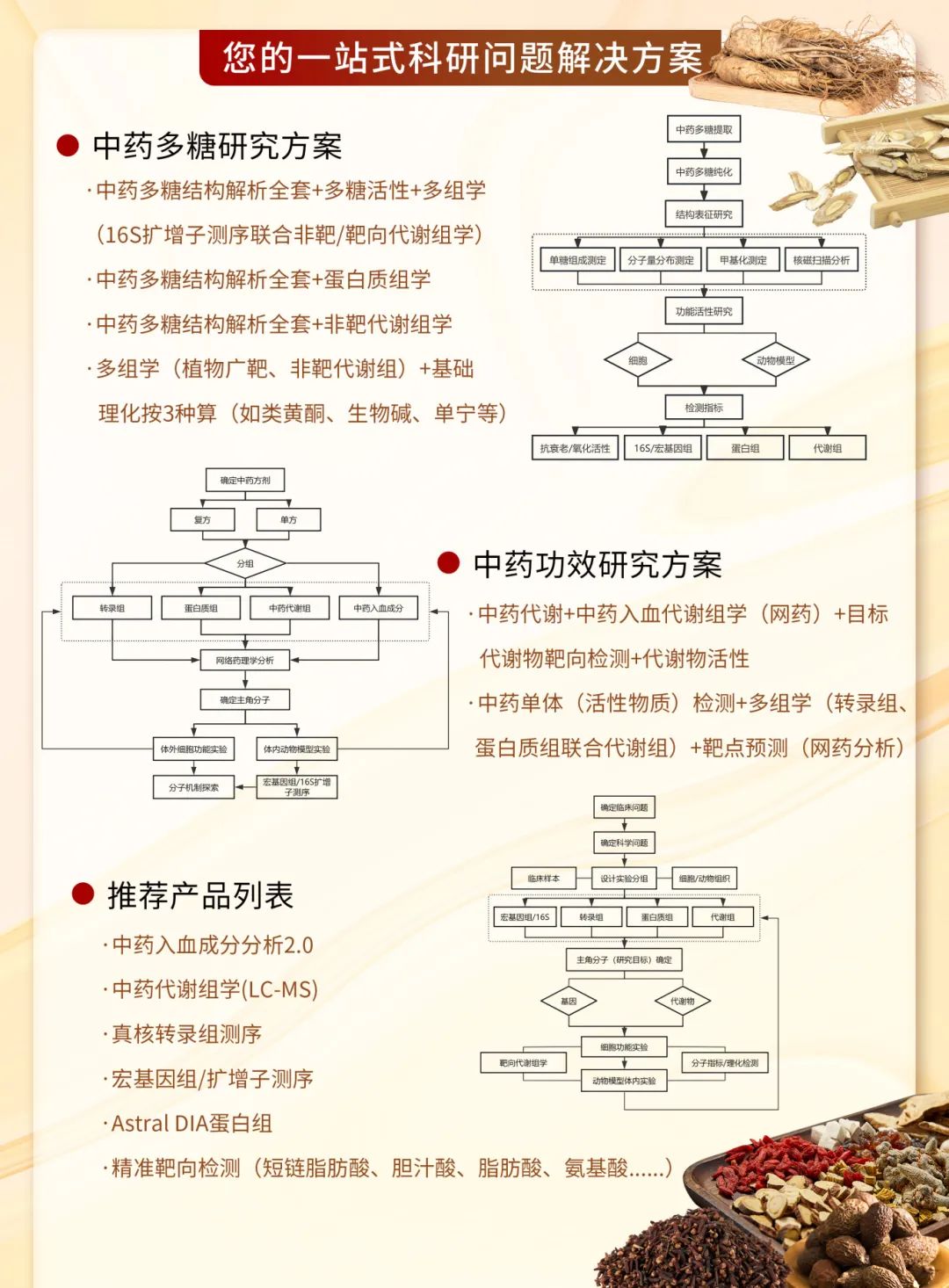
傳統(tǒng)中藥方劑因其復雜的多成分、多靶點特性,使得系統(tǒng)闡明其具體療效作用機制存在諸多挑戰(zhàn)。現(xiàn)代多組學技術為解析這些復方體系提供了新的助力。通過整合基因組學、轉錄組學、蛋白組學、代謝組學及微生物組學等分析手段,能夠構建從宏觀表型到微觀分子網(wǎng)絡的系統(tǒng)性研究路徑。
遵循“模型建立-藥物干預-多組學分析-機制驗證”的設計路線,首先在合適的模型體系中模擬目標病理狀態(tài),繼而引入方劑進行干預;隨后運用高通量多組學技術,全面描繪藥物作用對生物體在基因表達、蛋白質活性、代謝產(chǎn)物譜及共生微生物群落等層面的動態(tài)變化;最終通過分子生物學或功能實驗對篩選出的關鍵通路和靶點進行驗證,揭示中藥方劑發(fā)揮療效的整體調控網(wǎng)絡與協(xié)同作用本質。
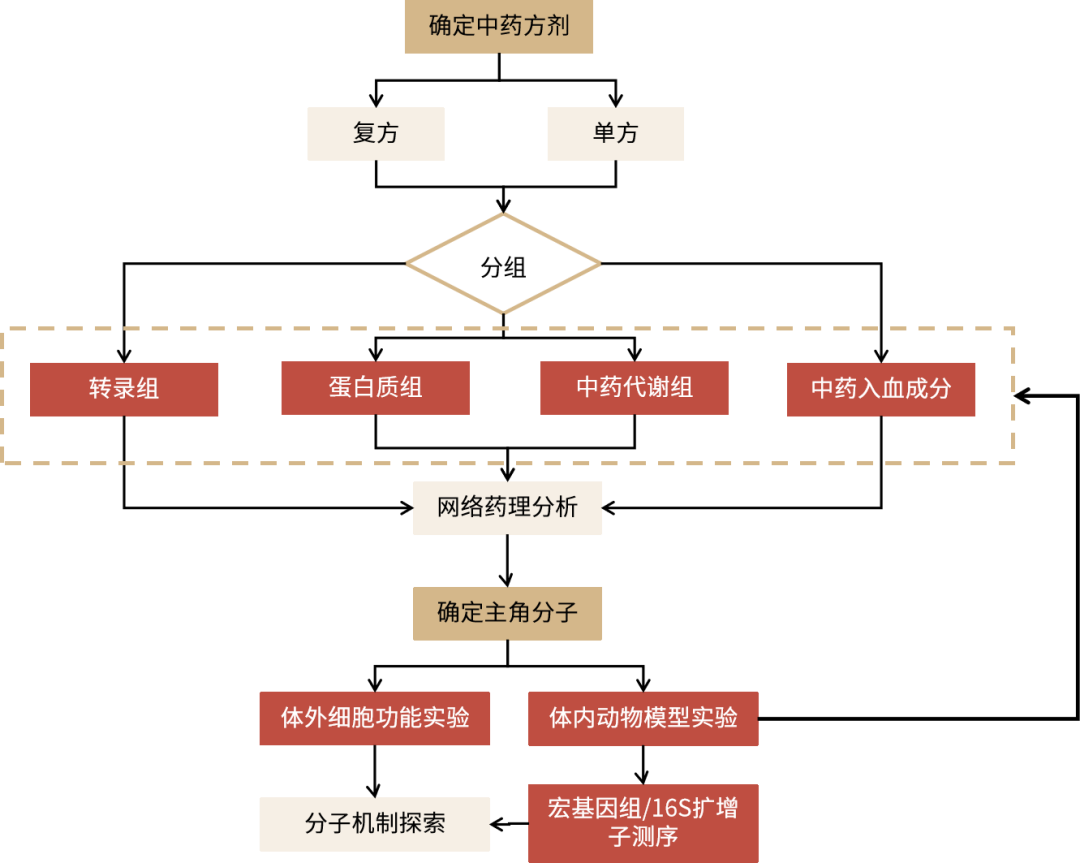
三黍中醫(yī)藥研究整體解決方案,更多服務詳情見鏈接:
潰瘍性結腸炎(Ulcerative Colitis, UC)是一種慢性腸道炎癥性疾病,全球發(fā)病率和死亡率持續(xù)上升。
傳統(tǒng)中藥方劑白頭翁湯(Pulsatilla Decoction)在治療UC中應用歷史悠久,其核心成分白頭翁(Pulsatillae radix)具有清熱解毒、涼血止痢的功效。近年研究發(fā)現(xiàn),白頭翁可通過調節(jié)腸道菌群和炎癥通路緩解UC,但改良方劑(Modified Pulsatilla Decoction, MPD)的機制仍需深入探究。
2025年5月12日發(fā)表于Frontiers in Microbiology的研究(標題:Modified Pulsatilla decoction ameliorates ulcerative colitis by affecting gut microbiota and metabolite profiles)中,作者構建"模型建立-藥物干預-多組學分析-機制驗證"的技術路線,通過體內實驗結合多組學技術探索改良白頭翁湯的作用機制,揭示了這種 MPD 有可能通過減少炎癥、調節(jié)腸道微生物群和腸道代謝來緩解 DSS 誘導的結腸炎。

動物模型:采用DSS(葡聚糖硫酸鈉)誘導的UC小鼠模型,模擬人類UC的腸道炎癥和黏膜損傷。
分組設計:正常對照組(無干預)、UC模型組(僅DSS誘導)和MPD治療組(高劑量組(H 劑量)和低劑量組(L 劑量)),每組8只小鼠。
16S rRNA測序,非靶代謝組學
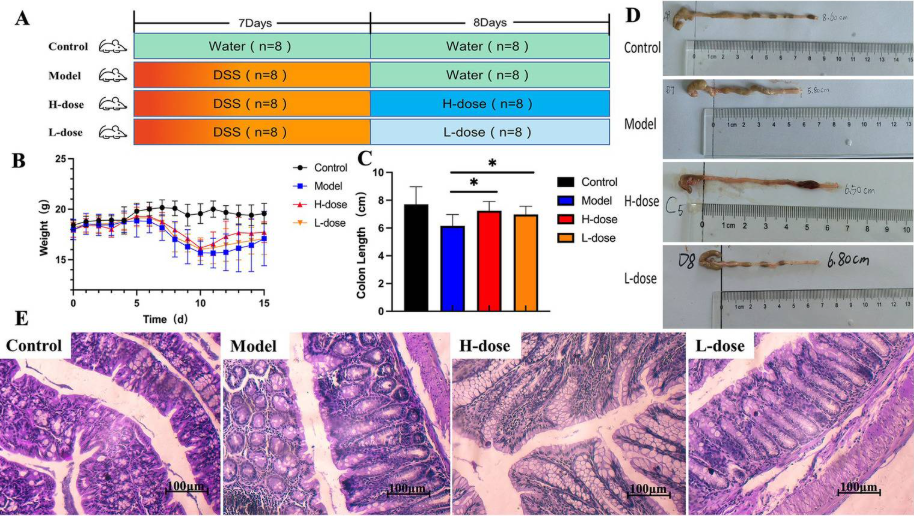
圖1. MPD 可顯著改善小鼠的結腸炎癥狀
1.MPD的化學成分
根據(jù) UHPLC-MS/MS 的正離子和負離子模式,將 MPD 總離子流色譜圖 (TIC) 的色譜圖分為兩組(圖 2A、B)。使用 Compound discover 3.2 軟件從原始 Raw 質譜數(shù)據(jù)中提取特征峰,特征峰元素匹配、分子式預測和同位素分布匹配的質量數(shù)偏差均設置為 5 ppm 以內。使用 mzCloud 在線數(shù)據(jù)庫和本地構建的中藥天然產(chǎn)物 mzVault 數(shù)據(jù)庫來識別特征峰,共鑒定出144 種化合物。峰面積最大的主要化合物包括黃芩苷、七葉苷、沃格諾苷等(圖 2D)。
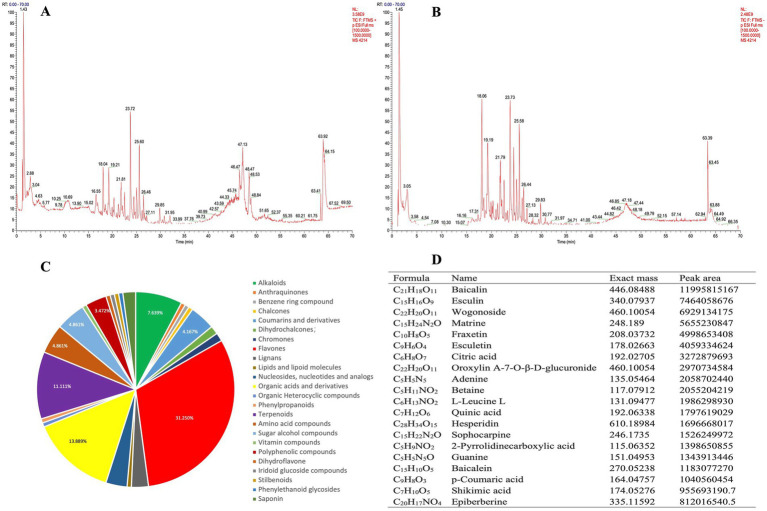
圖2. UHPLC-MS/MS 對 MPD 進行化學鑒定
2.MPD對小鼠體重和結腸的影響
研究人員將32只雄性 Balb/c 小鼠 (6-7周齡,20±2 g)隨機分為4組:對照組、模型組、H劑量組和L劑量組。如圖1A所示,模型、H 劑量和 L 劑量組施用3%(w/v) DSS溶液7天。在接下來的8天里,通常為每組小鼠提供無菌飲用水。L劑量組小鼠以10 g/kg的劑量給予粗草藥,H劑量組為20 g/kg。根據(jù)小鼠每10g體重0.1 mL的灌胃方案,對H劑量和L劑量組給予0.2 mL相應的湯劑。同時,在相同條件下,對照組和模型組給予0.2 mL無菌水。在整個實驗過程中,對照組都提供無菌水。
為了評估結腸炎的嚴重程度,研究人員記錄了所有小鼠的每日體重測量值。結果表明與對照組相比,所有DSS處理的小鼠均出現(xiàn)體重減輕。值得注意的是,與模型組相比,H 劑量組在高劑量MPD給藥期間的體重趨于增加(圖 1B)。DSS處理的小鼠也表現(xiàn)出較短的結腸長度,但MPD治療顯著逆轉了這些變化,尤其是在較高劑量下(圖 1C、D、p < 0.05)。H劑量組和L劑量組結腸組織的隱窩結構和形態(tài)均顯著改善,與DSS組相比,觀察到大量杯狀細胞并減少炎癥細胞浸潤。對照組腸道切片未發(fā)現(xiàn)明顯異常,上皮細胞層結構完整,無炎性細胞浸潤。相比之下,模型組表現(xiàn)出廣泛的炎癥細胞浸潤。H劑量組和 L 劑量組的上皮細胞層相對完整,炎癥細胞較少。H劑量組和L劑量組之間沒有顯著差異(圖 1E)。
3.MPD對糞便樣本微生物群多樣性和組成的影響
收集新鮮糞便后從中提取微生物DNA,對16S rRNA 基因的V3-V4區(qū)域進行擴增和測序。維恩圖顯示了三組中存在443個OTU(圖 3A),主坐標分析(PCoA) 揭示了對照組和 DSS 處理組之間不同的微生物組成集群(圖 3B)。這些結果表明 DSS 誘導小鼠糞便微生物群發(fā)生顯著變化。另外,與對照組相比,模型組和 H 劑量組的 Chao 1 和 Sobs 指數(shù)顯著降低 (p < 0.05),而 H 劑量組也表現(xiàn)出顯著較低的 ACE 指數(shù) (p < 0.05)。
研究人員進一步分析了門水平上最主要的微生物群,以評估各組之間腸道微生物群組成的總體變化(圖3C)。與對照組和 H 劑量組相比,模型組表現(xiàn)出較低的放線桿菌門相對豐度 (p < 0.05)。此外,模型組和H 劑量組均顯示彎曲桿菌門的相對豐度降低 (p < 0.05)。對每組中7 個主要屬的分析揭示了微生物類群的特定變化(圖 3D)。LEfSe 分析在對照組中確定了21個生物標志物,在模型組中確定了8個,在H劑量組中確定了4個生物標志物,表明由于DSS導致某些物種顯著減少,這導致DSS組盲腸微生物群的相對豐度較低(圖 4A)。葡萄球菌在門、屬和類水平 (LDA >4) 在模型組中占主導地位,而H劑量組(LDA >4)的Oscillospirates更豐富(圖4B)。
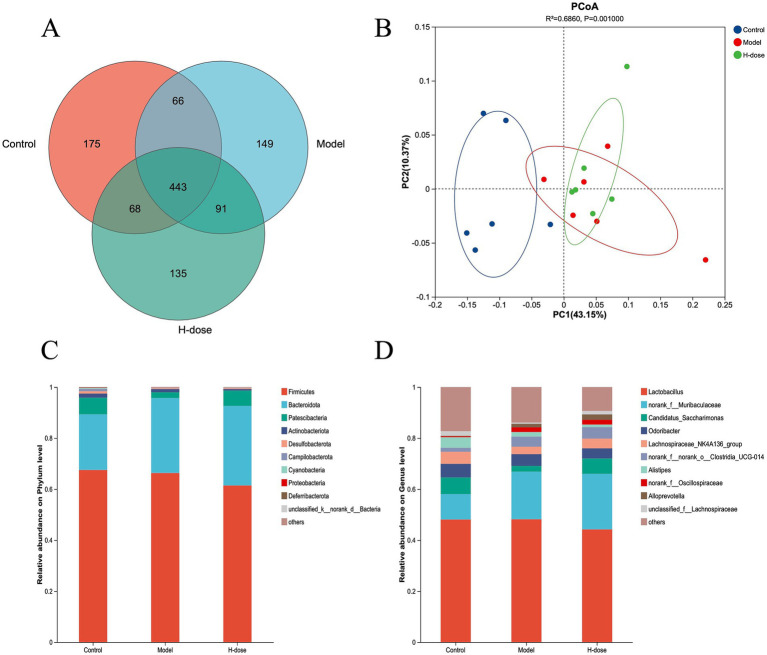
圖3. 不同組小鼠腸道微生物群
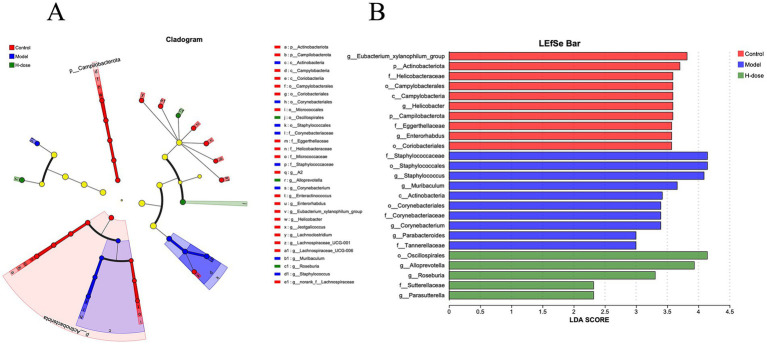
圖4. 描繪三組小鼠微生物群落之間分類關聯(lián)的LEfSe圖
4.MPD對腸道代謝的影響
通過LC-MS檢測結腸組織代謝物,篩選差異代謝物,并進行KEGG通路富集分析。正交偏最小二乘判別分析(OPLS-DA)表明對照組和模型組樣品之間有明顯的分離(圖 5A),表明成功建立了DSS誘導的潰瘍性結腸炎小鼠模型。MPD處理導致MPD和模型組樣品之間明顯分離(圖 5B)。差異代謝物的聚類熱圖分析顯示,MPD組的代謝物譜與對照組相似(圖 5C)。這些結果表明,MPD可有效改善DSS誘導的小鼠腸道代謝紊亂。
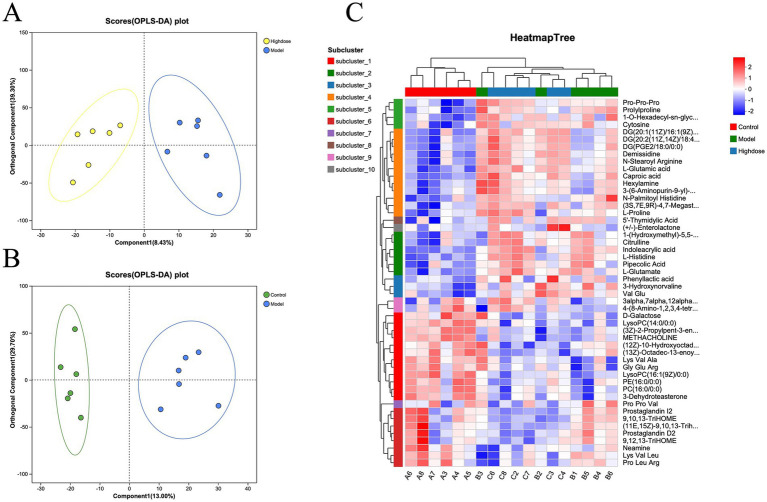
圖5. 三組小鼠微生物群落之間分類關聯(lián)的LEfSe圖
對模型組和 MPD 組代謝物數(shù)據(jù)的進一步分析顯示,與模型組相比,MPD 組有 53 種代謝物上調,22 種代謝物下調(圖 6A)。為了進行更精確的分析,使用投影中的變量重要性(VIP)表示差異代謝物(圖 6B)。倍數(shù)變化最大的前5位上調代謝物是(S)-7-(3-氨基-1-吡咯烷基)-1-環(huán)丙基-6-氟-1,4-二氫-4-氧代-1,8-萘啶-3-羧酸、Esculetin、戊二酸半醛、DTMP 和甘草酮。前五位下調代謝物包括依克多因、2-甲氧基雌酮、3-葡萄糖醛酸苷、蘇酰精氨酸、反式培苷和 13-L-氫過木酰油酸(圖 6C)。這些差異代謝物的 KEGG 富集分析表明,MPD主要影響亞油酸代謝、VEGF 信號通路、非洲錐蟲病、谷氨酸能突觸和 Fc ε RI 信號通路等通路(圖 6D)。
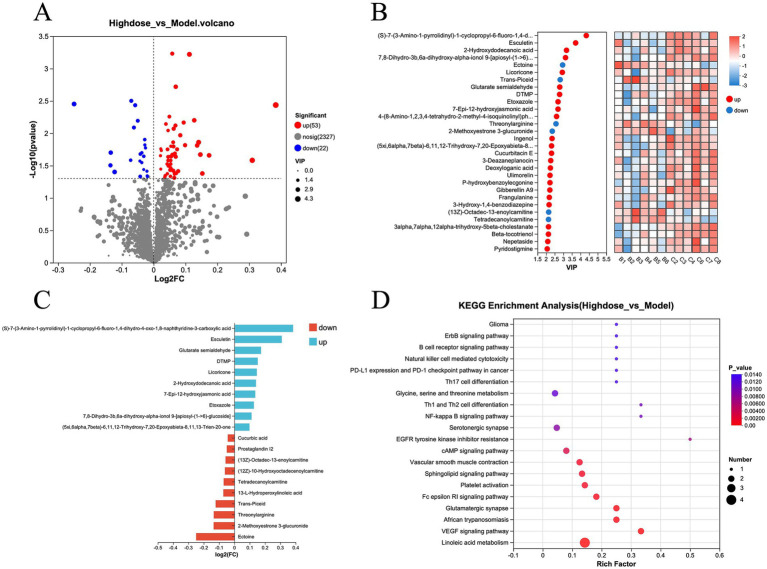
圖6 差異代謝物分析圖
創(chuàng)新點:首次闡明MPD通過菌群-代謝物-炎癥通路軸緩解UC,為中藥復方機制研究提供多組學整合范式。進一步研究預測的未知調控因子的功能。
臨床價值:MPD可能成為替代傳統(tǒng)免疫抑制劑的安全療法,尤其對激素抵抗型UC患者。
局限性:未解析MPD的具體活性成分;需擴大樣本量驗證菌群移植的因果性。
滑動查看更多:
排版:野凌
審核:三黍生物企宣部