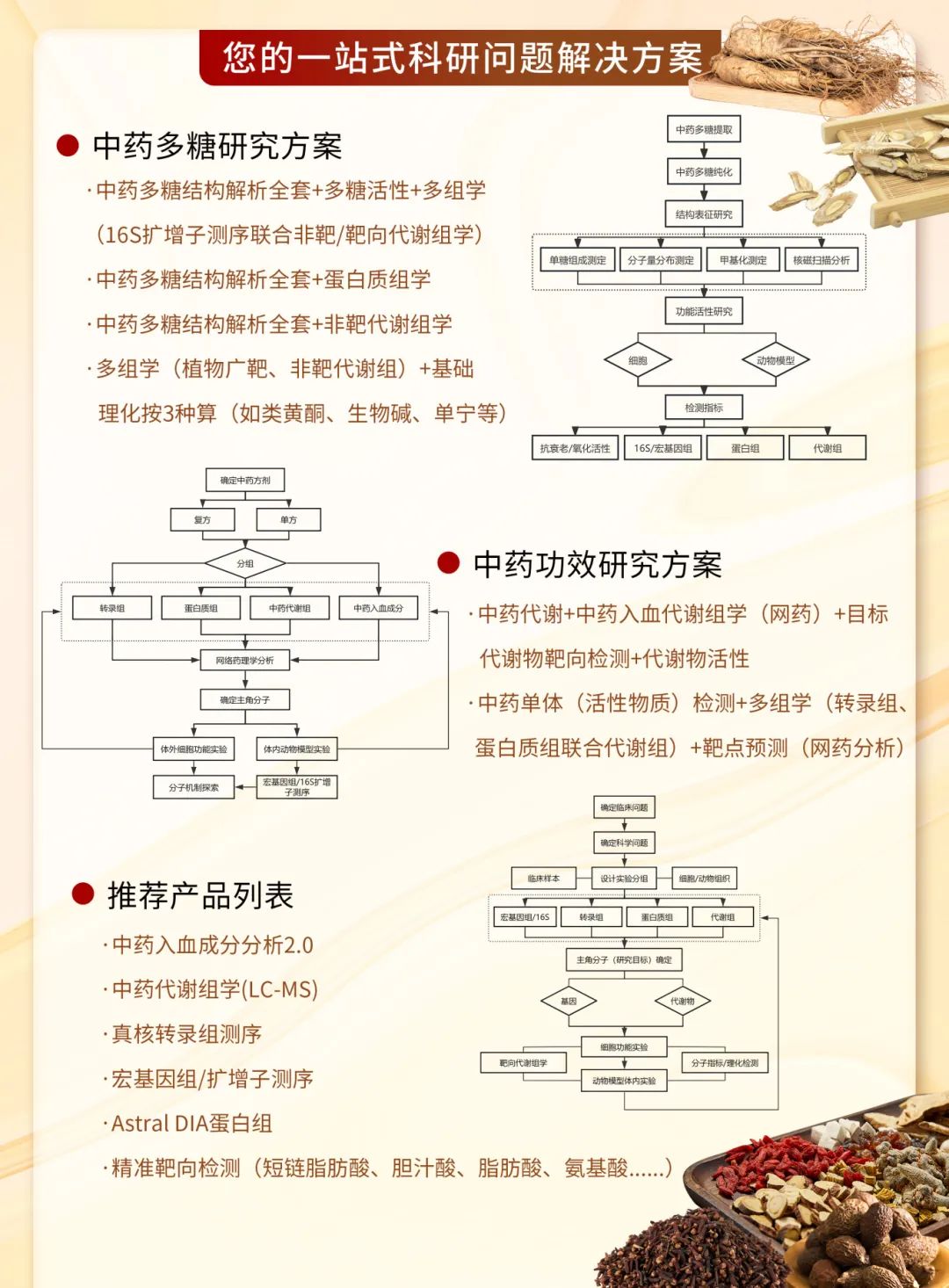
文獻解讀 | 網絡藥理能發IF 6.7?中藥復方分析利器,深度挖掘治療靶點

探究中藥復方治療疾病的物質基礎,長期受到成分復雜、體內過程不清等難點的瓶頸限制。中藥本身的活性成分、結構類似物、代謝產物、與體內成分結合的產物等物質往往在進入血液后方可產生藥理作用。直接分析藥材或制劑成分難以準確反應中藥復方真正在體內起效的活性物質。

基于該研究特點,中藥入血成分分析結合網絡藥理學的研究思路應運而生:通過篩選被機體吸收并存在于血液中的代謝物圖譜,將研究焦點從“藥材中有什么”轉向“體內發揮作用的是什么”,為揭示中藥復方在體內的直接作用物質提供了有力的驗證依據。
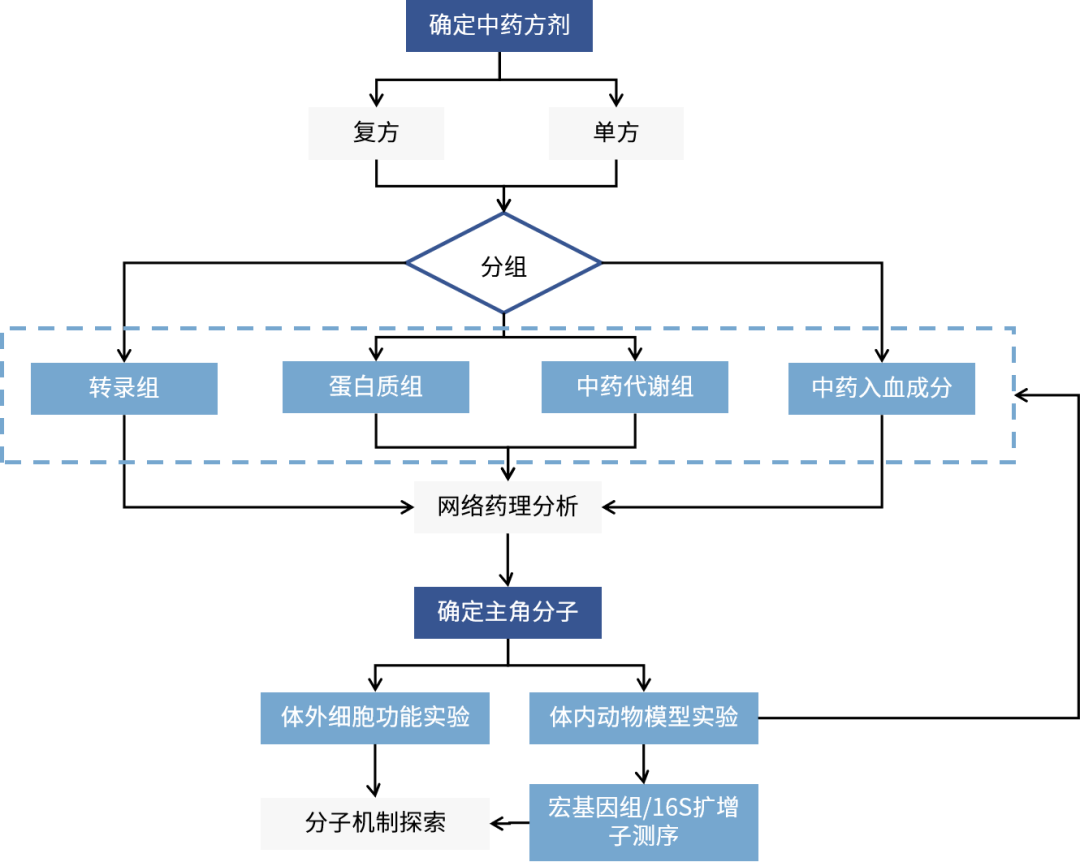
研究路線框架圖
以中藥入血成分分析為基礎,結合網絡藥理學、多組學數據、動物模型驗證等,能夠進一步挖掘中藥入血成分分析數據價值,結合疾病靶點數據庫和生物通路知識,構建“成分-靶點-通路-疾病”的多維互作網絡模型:一方面預測入血成分潛在的作用靶點和調控通路,為機制研究提供清晰的假說和優先方向;另一方面驗證和闡釋已知藥效的表型背后復雜的分子網絡調控基礎。

阿霉素(DOX)是一種廣泛使用的蒽環類化療藥物,對多種惡性腫瘤具有療效。然而,其臨床應用因劑量依賴性的心臟毒性而受到限制。苓桂術甘湯(LGZGD)是一種傳統的中藥方劑,已有研究顯示其具有心臟保護作用,但其對 DOX 誘導的心臟毒性(DIC)的作用及機制尚未明確。
遼寧中醫藥大學李學濤教授團隊于2025年2月在Phytomedicine (IF=6.7)雜志上發表了題為“Linggui Zhugan decoction ameliorating mitochondrial damage of doxorubicin-induced cardiotoxicity by modulating the AMPK-FOXO3a pathway targeting BTG2”的文章,該研究首次發現苓桂術甘湯通過靶向 BTG2 調控 AMPK-FOXO3a 信號通路,改善阿霉素誘導的心肌線粒體結構與功能損傷,為中藥干預化療性心臟毒性提供了全新的作用機制與治療靶點。

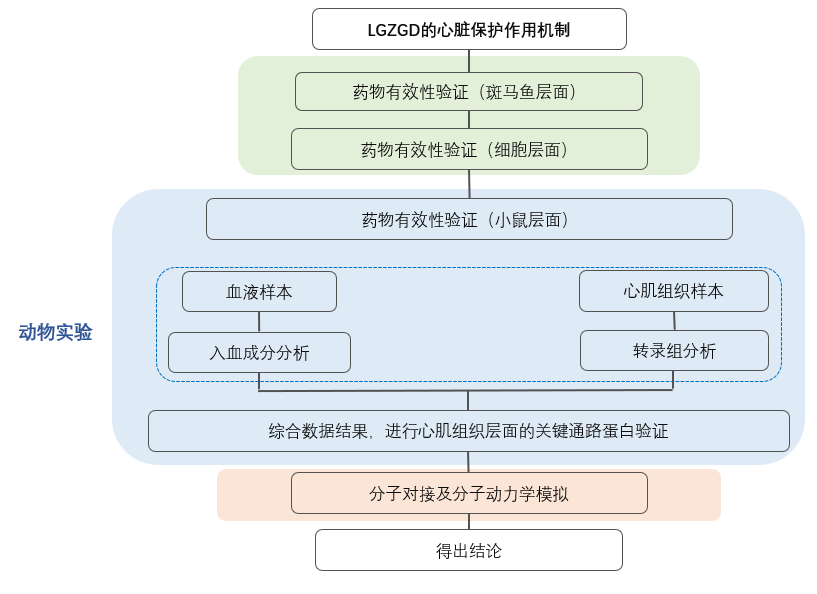
研究對象:斑馬魚及小鼠模型,體外心肌細胞
技術方法:入血成分分析,心臟組織轉錄組,網絡藥理學,分子對接,分子動力學模擬,組織切片研究,炎癥因子檢測,WB等
技術路線:
1.LGZGD改善了斑馬魚胚胎和成年斑馬魚的DIC
為評估LGZGD緩解DIC的療效,使用斑馬魚胚胎構建模型。首先,通過將斑馬魚胚胎培養物暴露于含有DOX的E3溶液中(濃度分別為200、150、125、100、75、50和25 μM)48小時,確定了適當的DOX劑量。100-200 μM組的死亡率為100%,而75 μM組的死亡率為36.67%,并伴有心包水腫。相反,25-50 μM的DOX濃度未引起心包水腫。基于這些結果,選擇75 μM DOX作為最佳建模劑量(fig S1)。
接下來,評估了LGZGD的暴露劑量。在20 mg/ml時,LGZGD導致胚胎30%的死亡率,而0-10 mg/ml的濃度未顯示死亡率。因此,選擇了2.5、5和10 mg/ml的濃度進行進一步研究(fig S2)。在受精后一天(1 dpf)的斑馬魚胚胎中,單獨使用DOX或與不同濃度LGZGD聯合進行處理(fig 1A)。DOX暴露導致心包水腫、心房變薄、變形為細長形狀以及心室密集(fig 1B)。LGZGD治療顯著減輕了這些形態異常,減少了水腫,并恢復了正常的心臟結構(fig 1B)。DOX處理的胚胎心率略有下降,但LGZGD在所有測試濃度下逆轉了這一效應(fig 1C)。暴露于DOX(包括75μM)的斑馬魚胚胎存活率明顯降低,而LGZGD聯合治療顯著提高了1、2和3 dpf時的存活率(fig 1D)。這些發現表明,LGZGD減輕了DOX誘導的斑馬魚胚胎形態和功能損傷,進一步緩解了DIC。
雖然斑馬魚胚胎可以提供一個快速的模型來研究急性DIC,但它們主要反映急性階段的心臟毒性。因此,DIC的胚胎模型不能充分代表化療幾個療程后甚至幾年后腫瘤患者可能出現的遲發性心臟毒性。
為了評估LGZGD對慢性DIC的影響,采用了成年斑馬魚模型(fig 1E)。治療從注射后28天開始。接受DOX處理的斑馬魚表現出顯著的生長抑制,表現為體重減輕,而LGZGD緩解了這一現象(fig 1F)。組織學分析顯示,DOX導致心肌纖維不規則、心肌收縮功能受損、心肌纖維丟失以及大量膠原沉積。LGZGD保留了心肌的完整性,改善了心肌收縮,并減少了膠原積累(fig 1G–I)。這些結果表明,LGZGD具有對抗成年斑馬魚中DOX誘導的慢性DIC的潛力。
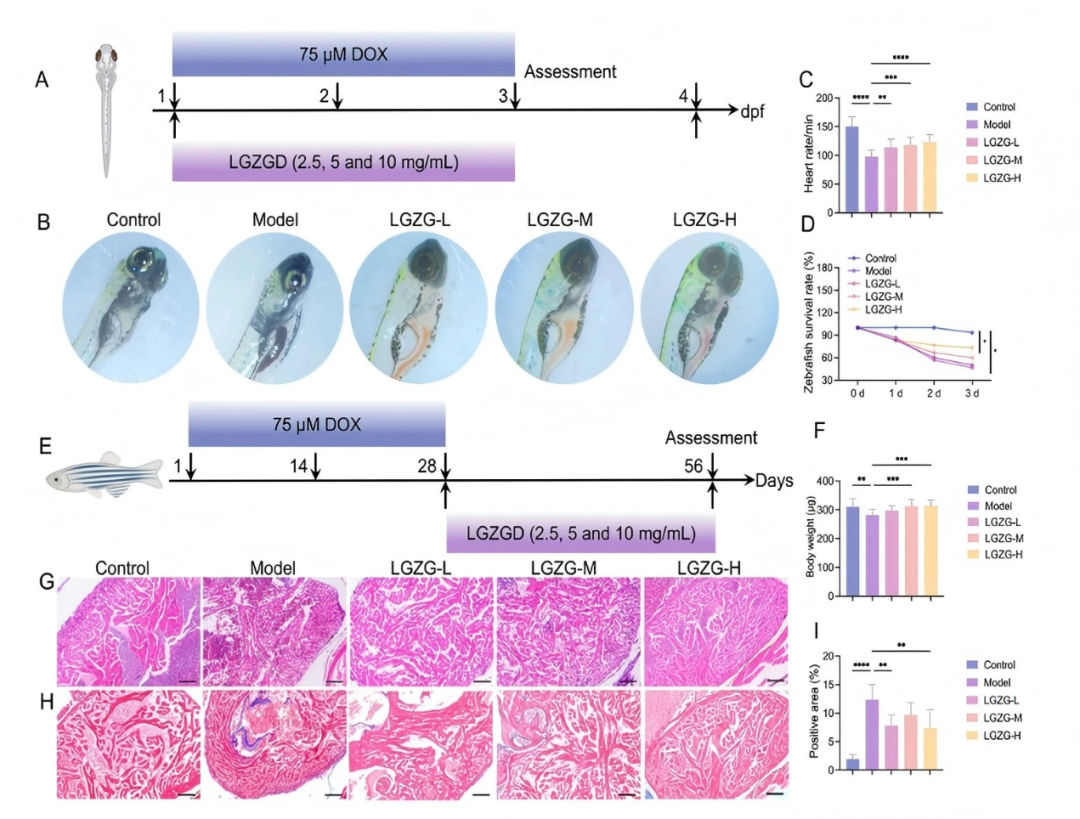
圖1. LGZGD改善了斑馬魚胚胎和成年斑馬魚的DIC
2.LGZGD減輕了DOX誘導的心肌細胞壞死、凋亡、氧化應激和炎癥
在體外實驗中,為了確定DOX和LGZGD的最佳濃度,作者對心肌細胞存活率進行了評估。選擇2μM DOX誘導心肌細胞(H9c2細胞)損傷。LGZGD (0~80 mg/ml)顯著降低H9c2細胞的存活率,但在10 mg/ml時,存活率仍保持在90 %。因此,選擇10 mg/ml作為LGZGD治療的最大濃度。LGZGD部分恢復了經DOX處理的 H9c2 細胞的存活率和正常形態(fig 2C-D),并顯著降低了 LDH、CK-MB、cTnI 和cTnT的水平(figS3),這表明LGZGD緩解了DOX誘導的細胞損傷。此外,LGZGD減少了PI陽性細胞的數量(fig2E),并抑制了DOX誘導的細胞凋亡(fig2F-G),表明LGZGD改善了H9c2細胞的壞死和凋亡。作者通過DCFH - DA探針和流式細胞術評估細胞內ROS水平,發現LGZGD顯著降低細胞內ROS水平(fig2H-K)。另外,LGZGD在一定程度上提高了GSH和SOD活性,降低了MDA含量(figS4)。LGZGD顯著抑制DOX處理的H9c2細胞中的促炎細胞因子的升高,包括IL-1β、IL-6和TNF-α(figS5)。這些結果綜合表明LGZGD減輕了氧化應激、炎癥和細胞凋亡,突出了其對抗DIC的治療潛力。
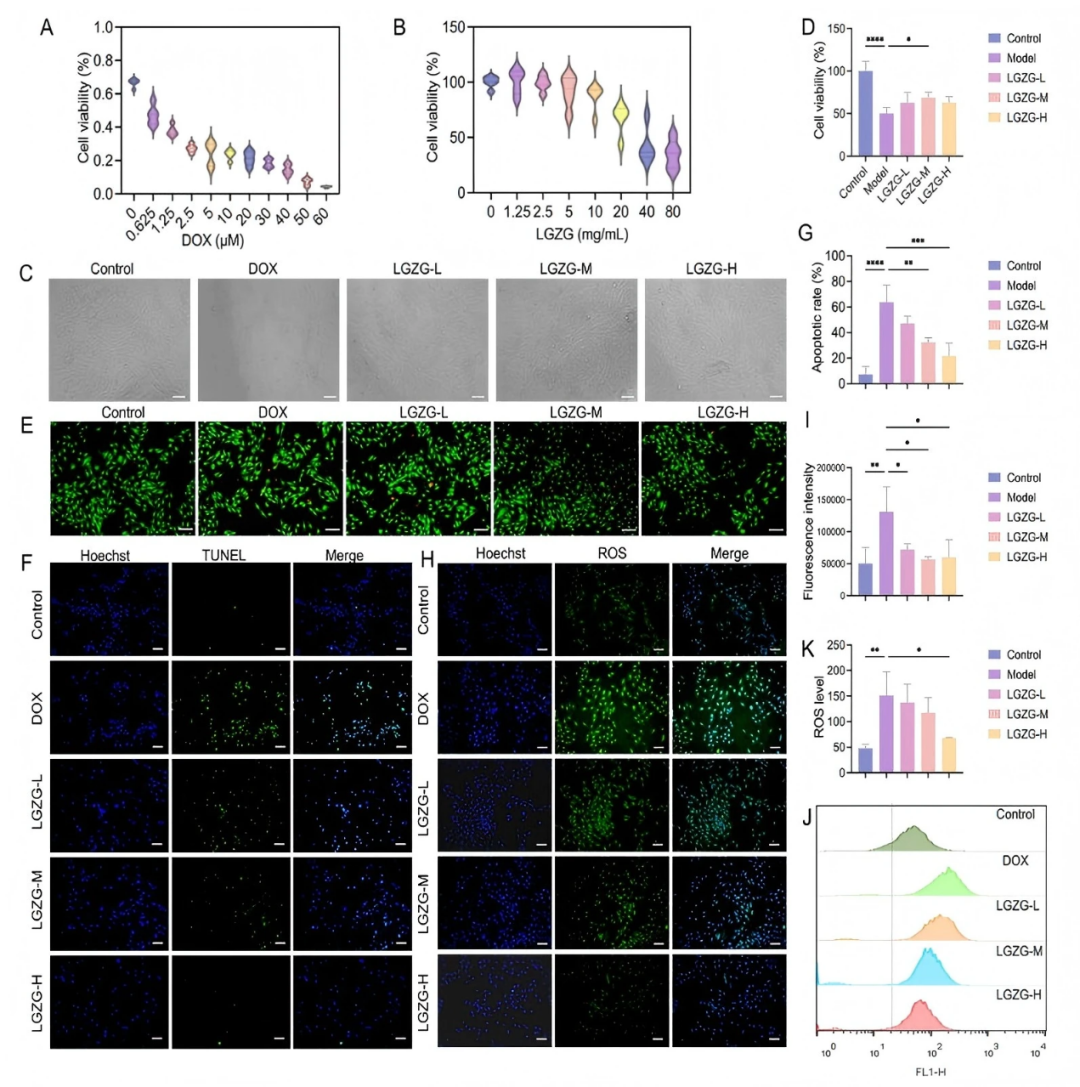
圖2. LGZGD改善了DOX誘導的心肌細胞壞死,凋亡,氧化應激和炎癥
3.LGZGD減輕了DOX誘導的H9c2細胞線粒體損傷
作者使用JC-1染色評估了LGZGD對線粒體膜電位(MMP)的影響。結果表明,與對照組相比,DOX處理的細胞顯示出顯著的MMP降低(fig 3A–D)。然而,不同濃度的LGZGD處理以劑量依賴性方式顯著恢復了MMP(fig 3A–D)。為了評估線粒體形態,進行了Mito-Tracker Green染色。在對照組中,線粒體呈現出清晰的網格狀結構,而DOX處理導致H9c2細胞線粒體充盈和異常分裂。不同濃度的LGZGD處理有效逆轉了這些結構異常,減少了線粒體分裂并保留了網格狀形態(fig 3E)。這些結果表明,LGZGD通過維持線粒體完整性和功能來保護免受DOX誘導的線粒體損傷。
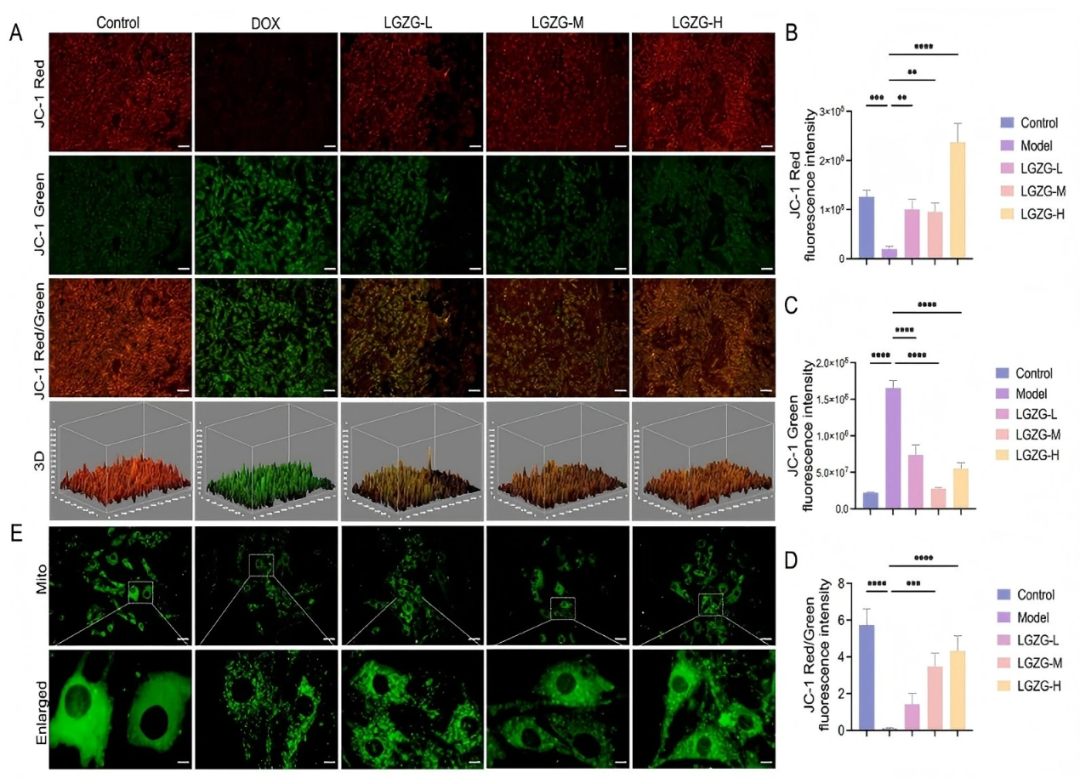
圖3. LGZGD減弱了DOX誘導的H9C2細胞中的線粒體損傷
4.LGZGD緩解了DIC小鼠的心臟功能障礙
通過每 3 天腹腔注射 DOX 持續 3 周建立 DIC 小鼠模型,隨后進行 30 天的 LGZGD 治療(fig 4A)。與對照組相比,DOX 組小鼠心臟重量顯著減輕,而 LGZGD 治療顯著增加心臟重量(fig 4B、C)。LGZGD 還以劑量依賴性方式逆轉了 DOX 誘導的體重下降(fig 4D-I)。有趣的是,在各組之間未觀察到心臟與體重比的顯著變化(fig 4J)。超聲心動圖分析顯示,DOX 治療顯著降低波形振幅并減弱壁運動(fig 4K、L)。定量測量表明,與對照組相比,DOX 組左心室射血分數(LVEF)和左心室短軸縮短率(LVFS)顯著降低,左心室收縮末期內徑(LVIDs)顯著增加(fig 4M-P)。相比之下,LGZGD 治療可顯著緩解心臟功能障礙,減少 DOX 引起的 LVEF、LVFS 下降及 LVIDs 增加(fig 4M-P),顯示出對心臟功能的保護作用。
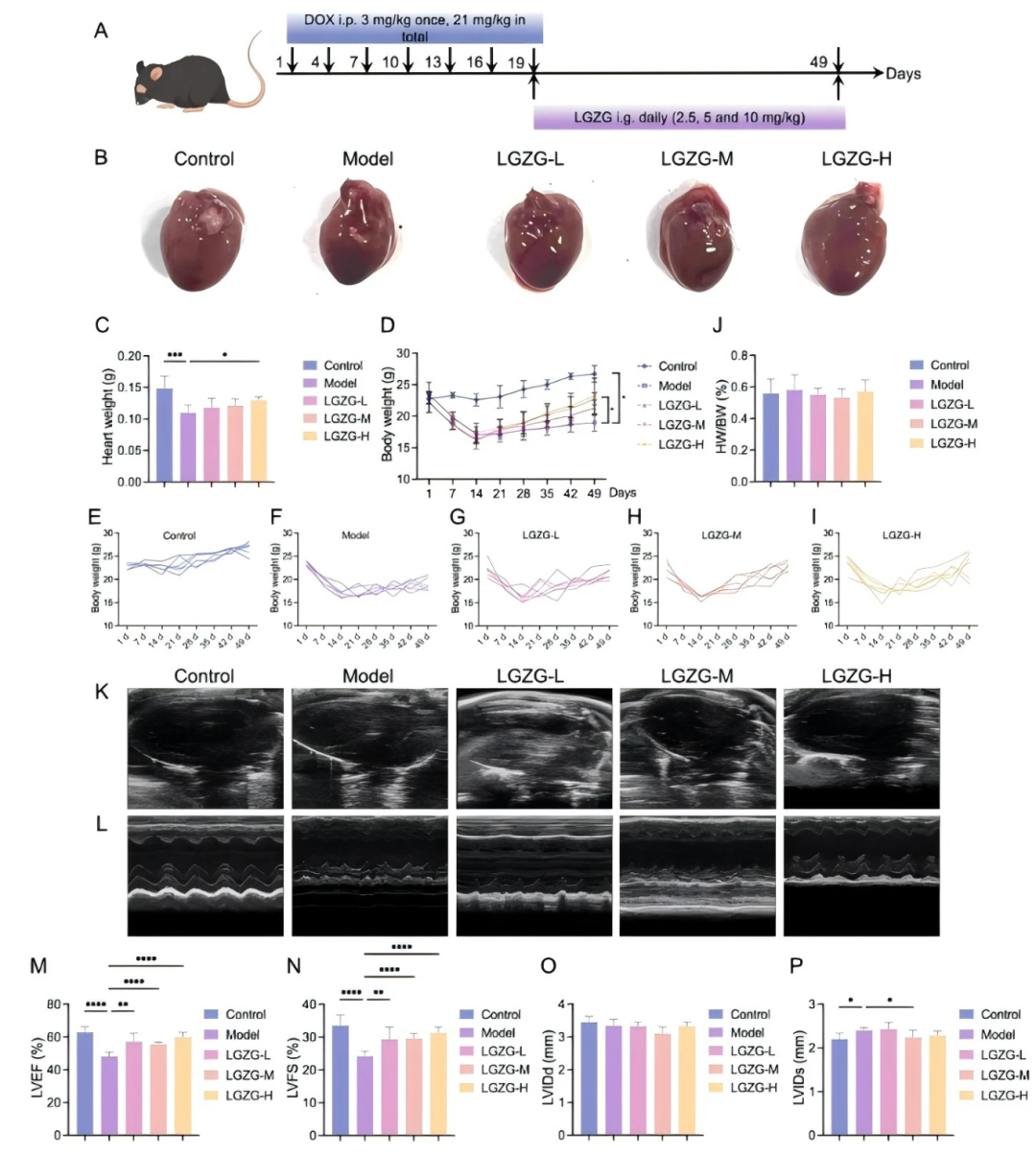
圖4. LGZGD減輕了DIC小鼠的心臟功能障礙
5.LGZGD減輕了DIC小鼠的心臟損傷
心肌組織的組織病理學分析顯示,DOX誘導的嚴重損傷,包括心肌細胞排列紊亂、心肌水腫、血管擴張、充血和炎性細胞浸潤。LGZGD治療顯著減輕了這些影響,從而改善了心肌纖維組織,減少了炎癥浸潤(fig5A-B)。對照組小鼠心肌細胞排列整齊,細胞核集中于肌細胞內。相反,在DOX組中,心肌細胞表現出明顯的結構紊亂,排列紊亂,心肌間質擴大。此外,還觀察到炎癥細胞浸潤,心肌損傷評分顯著升高。然而,使用 LGZGD 進行治療可減輕這些病理變化。心肌細胞結構更加有序,炎性浸潤明顯減少,心肌損傷評分呈劑量依賴性降低。Masson染色(fig5C-D)和天狼星紅染色(fig5E-F)顯示DOX組有明顯的心肌纖維化和膠原沉積。這些纖維化改變在LGZGD給藥(fig5C-F)后明顯減輕。此外,WGA染色顯示DOX組心肌細胞明顯小于對照組。LGZGD治療有效地增加了心肌細胞的大小,使其恢復到正常尺寸(fig5G-H)。DOX處理的小鼠血清中LDH、CK - MB、cTnI和cTnT水平升高,LGZGD治療后顯著降低(figS6)。這些發現證實了LGZGD對DOX誘導的心肌損傷的實質性保護作用。
心肌細胞凋亡主要由氧化應激和炎癥反應驅動,是心肌損傷的重要因素。為了進一步探索這一點,作者檢測了不同處理后心臟組織中的氧化應激標志物、炎癥介質和細胞凋亡。與對照組相比,DOX處理組小鼠GSH和SOD活性顯著降低,MDA、IL-1β、IL-6和TNF-α水平顯著升高。LGZGD 治療則逆轉了這些效應,顯著提高了GSH和SOD的活性,同時顯著降低了MDA、IL-1β、IL-6和TNF-α的水平(figS7-S8)。此外,基于超氧陰離子熒光探針二氫乙啶( DHE )的熒光,作者觀察到DOX組心臟組織中ROS積累增加,表現為熒光強度增強。LGZGD治療顯著降低了心肌中的ROS水平,表明其抗氧化功效(fig5I-J)。TUNEL染色進一步揭示了DOX組中廣泛的心肌細胞凋亡,LGZGD干預(fig5K-l)后顯著減少了心肌細胞凋亡。總的來說,這些結果表明LGZGD有效地減輕了氧化損傷、炎癥反應和細胞凋亡,從而保護心臟組織免受DOX誘導的損傷。
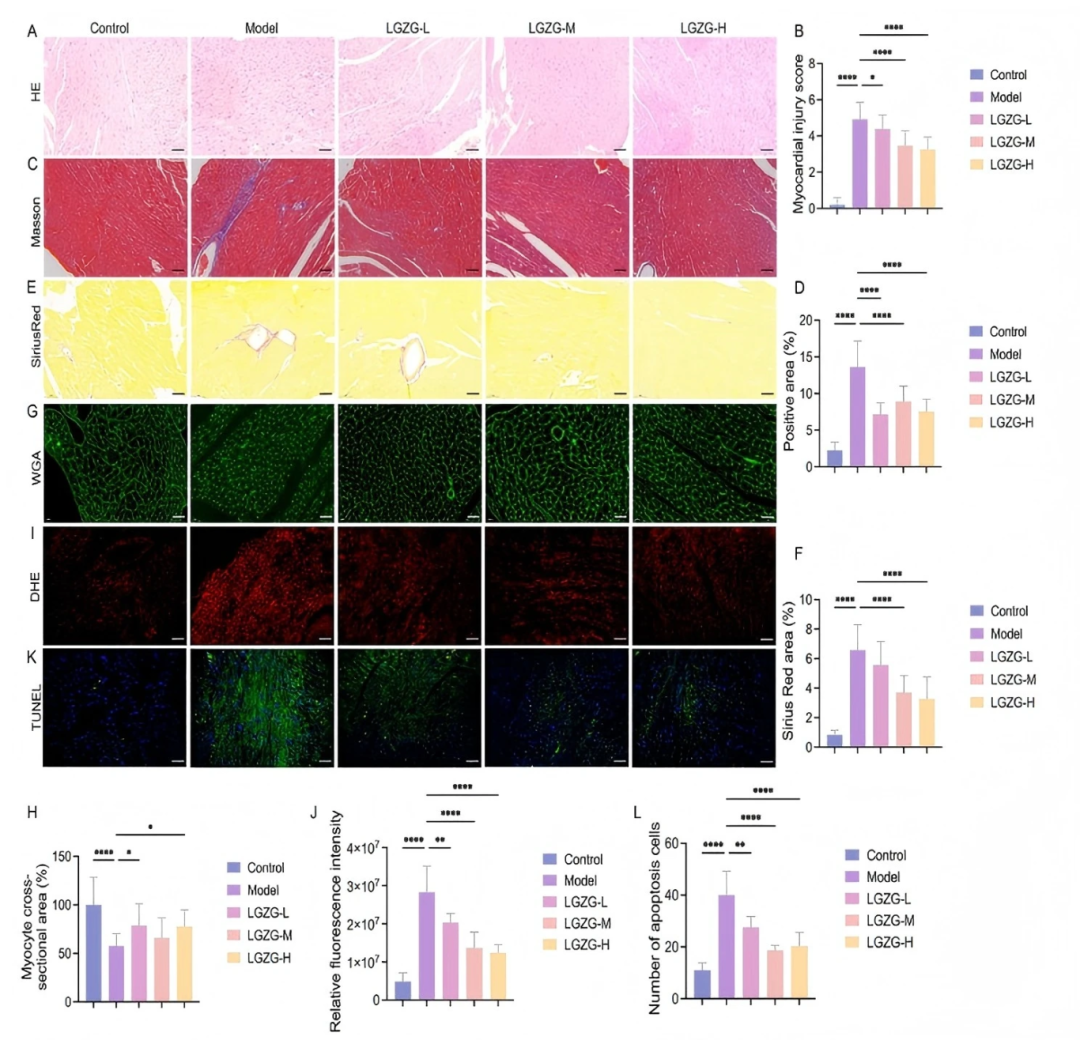
圖5. LGZGD減輕DIC小鼠的心臟損傷
6.LGZGD逆轉了DOX誘導的小鼠線粒體損傷
線粒體是ROS產生的主要場所,在細胞能量代中發揮核心作用。為了評估LGZGD對DOX誘導的線粒體損傷的影響,使用透射電子顯微鏡檢查心臟組織的亞細胞結構。在DOX處理的小鼠中,心肌細胞顯示出明顯的線粒體異常,包括嵴斷裂、皺縮、局灶性空泡化和線粒體密度的顯著降低(fig6A)。LGZGD處理后線粒體形態接近正常,嵴結構恢復,空泡化減少,密度增加,表明LGZGD對DOX誘導的線粒體損傷具有保護作用。線粒體功能障礙常導致ATP生成障礙和Ca2+-ATP酶活性降低,最終導致能量代謝紊亂。在DOX組,心肌ATP水平和Ca2+-ATP酶活性顯著降低,反映能量代謝受損。LGZGD處理恢復了這些水平,突出了其在改善線粒體功能和能量平衡中的作用(fig6B-C)。綜上所述,LGZGD可有效改善DOX誘導的線粒體損傷,支持能量代謝恢復,并有助于維持心臟功能。
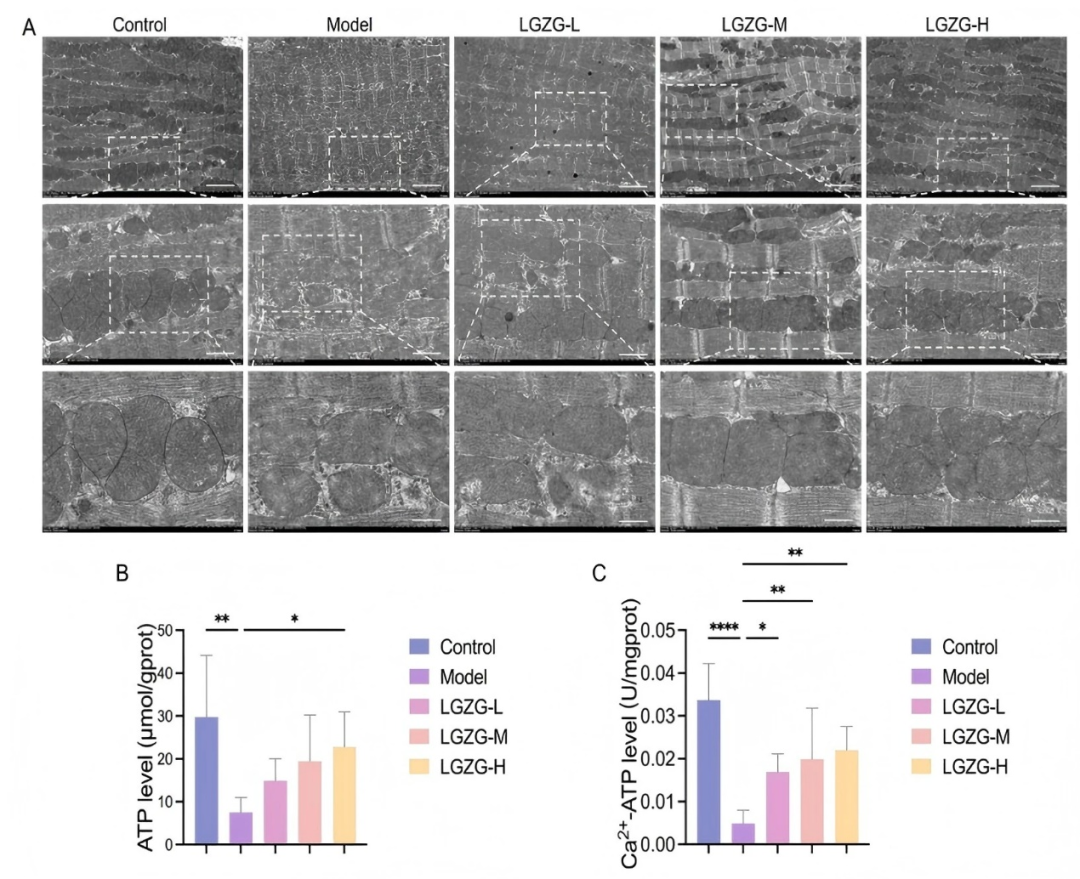
圖6. LGZGD逆轉了DOX誘導的小鼠線粒體損傷
7.LGZGD入血成分分析
為了闡明LGZGD治療DIC的藥效基礎和分子機制,作者對其成分進行了全面分析。采用超高效液相色譜 - 四極桿 - 軌道阱高分辨質譜(UHPLC-Q-Orbitrap HRMS)鑒定LGZGD的組成(fig7A-D)。在LGZGD中總共鑒定到155個成分,其中37個成分為入血成分。這些成分可能作為LGZGD治療DIC的活性成分。
為進一步探討LGZGD的作用機制,作者采用網絡藥理學方法預測其潛在的治療靶點。總共有512個靶點與LGZGD入血成分相關,167個靶點與DIC相關。其中,重疊靶點46個(fig7E)。利用Cytoscape軟件,構建藥物成分-靶點網絡(fig7F)。預測具有顯著治療潛力的核心成分包括甘草素、3′-甲氧基光甘草定、光甘草定、16α-羥基脫氫曲美烯酸、glepidotin A、粗毛豚草素、粗毛甘草素A和粗毛甘草素B。將LGZGD和DIC的46個重疊靶點輸入STRING數據庫,生成PPI網絡圖。關鍵干預靶點主要包括AKT1、HIF1A、TNF、BCL2、PTGS2、HSP90AA1、EGFR、CASP3、ERBB2和STAT3(fig7G)。
GO功能富集分析表明 LGZGD 治療 DIC 的潛在靶點主要富集于氧化應激反應、線粒體功能調控等生物過程及 ATP 結合等分子功能(fig7H)。KEGG富集分析結果表明LGZGD治療DIC的靶點主要涉及癌癥相關通路、HIF-1信號通路、FOXO信號通路、糖尿病并發癥中的AGE-RAGE信號通路、PI3K-Akt信號通路、VEGF信號通路等(fig7I)。
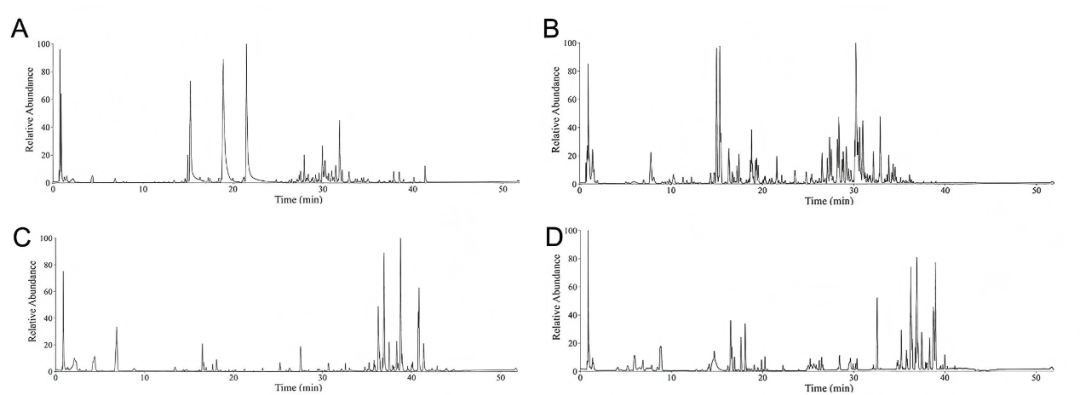
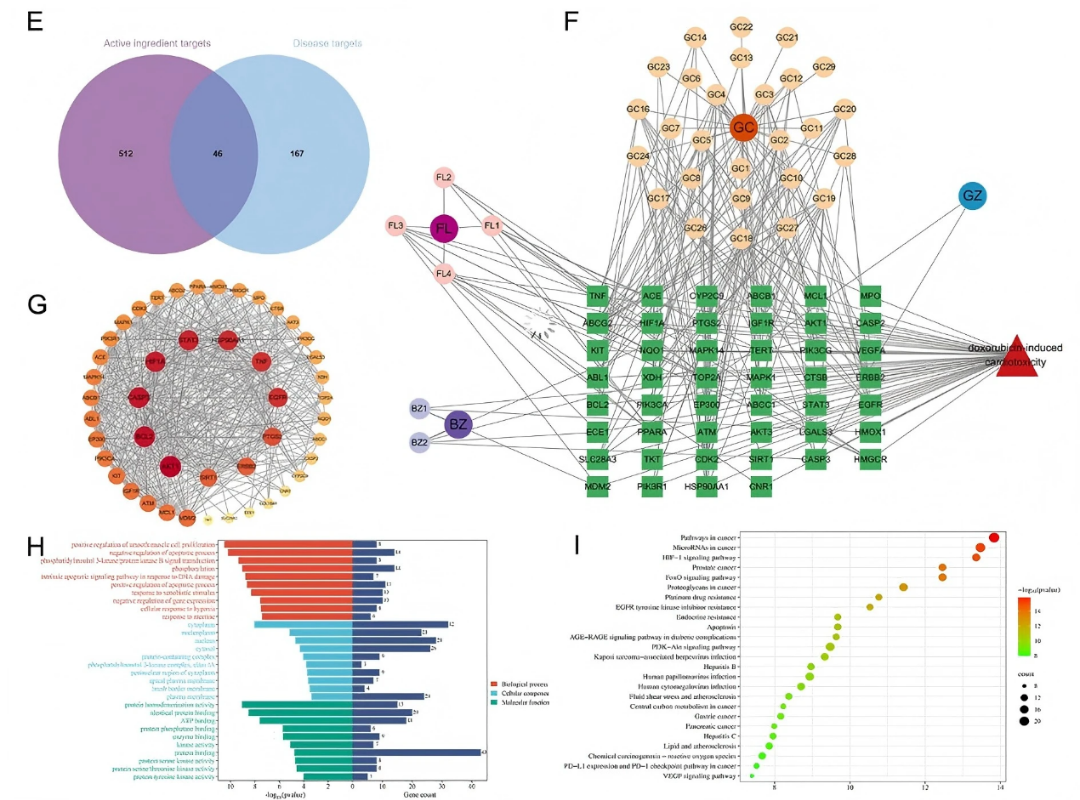
圖7. LGZGD抗DIC的主要成分和網絡藥理靶點預測
| 三黍服務 | 技術參數 |
中藥代謝組學 | |
中藥入血成分分析 | |
真核轉錄組測序 | |
宏基因組測序 | |
更多服務,歡迎私信詳詢! | |
8.轉錄組學分析揭示了LGZGD治療DIC的關鍵信號通路
作者采用轉錄組學研究LGZGD干預后心臟組織中的差異基因表達,闡明其治療DIC的潛在機制,小提琴圖表明樣品的質量合格并適合用于后續分析(fig8A)。火山圖表明,與對照組相比,模型組有105個差異基因:(53個上調基因和52個下調基因)(fig8B)。與模型組相比,LGZGD 治療有29個基因發生變化(7個上調基因和22個下調基因)。這些顯著差異基因的聚類結果以熱圖形式展示(fig8C)。GO分析顯示,LGZGD相關的生物過程主要涉及行為反應、生物調節、細胞組織或生物發生和細胞組成(fig8D-E)。KEGG富集分析突出了LGZGD影響的通路,包括通過細胞色素P450的藥物代謝,脂肪酸代謝,通過細胞色素P450的PPAR藥物代謝,脂肪酸重編程,PPAR信號,AMPK信號和PI3K - Akt信號(fig8F-G)。
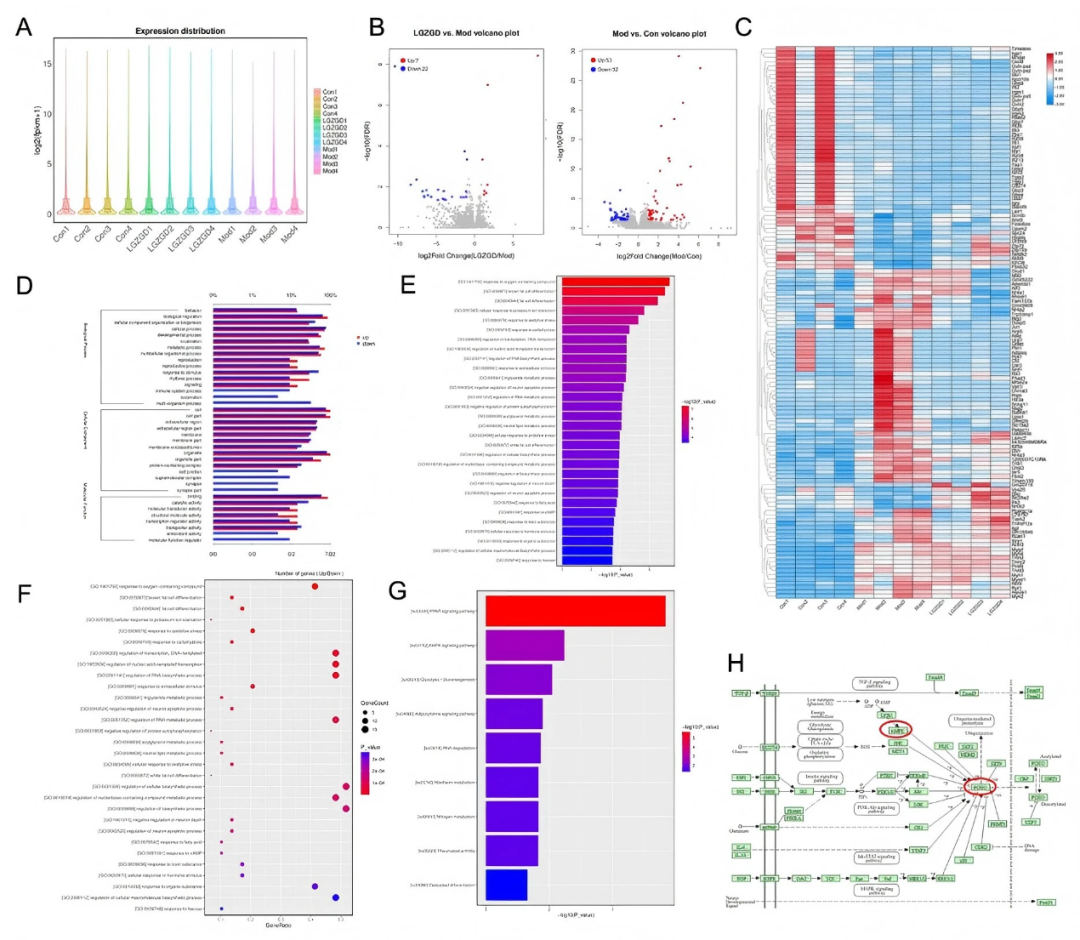
圖8. 轉錄組學分析揭示了LGZGD治療DIC的信號通路
9.LGZGD在體內調節BTG2和AMPK-FOXO3a信號通路的活性
基于網絡藥理學和轉錄組學,AMPK-FOXO3a信號通路成為LGZGD發揮治療作用的關鍵機制。在鑒定的29個差異表達基因中,AMPK-FOXO3a信號通路中的關鍵調節因子BTG2在LGZGD處理后表達顯著降低(figS9A)。為了驗證這一發現,作者進行了RT-PCR檢測。結果表明,在模型組中,BTG2 mRNA 的表達顯著升高,而 AMPK和FOXO3a mRNA 的表達則顯著降低。LGZGD處理逆轉了這些趨勢,顯著降低了BTG2 mRNA,增加了AMPK和FOXO3a mRNA的表達(figS9B)。在蛋白水平,與對照組相比,模型組BTG2表達顯著升高,而磷酸化AMPK (p-AMPK )與總AMPK的比值和磷酸化FOXO3a (p-FOXO3a )與總FOXO3a的比值顯著降低。LGZGD處理逆轉了這些效應,顯著降低了BTG2蛋白表達,同時顯著增加了p-AMPK / AMPK和p - FOXO3a / FOXO3a水平(fig9A–D)。這些發現表明LGZGD通過下調BTG2蛋白表達和增強AMPK - FOXO3a信號通路的激活來緩解DIC,從而減輕心肌損傷。
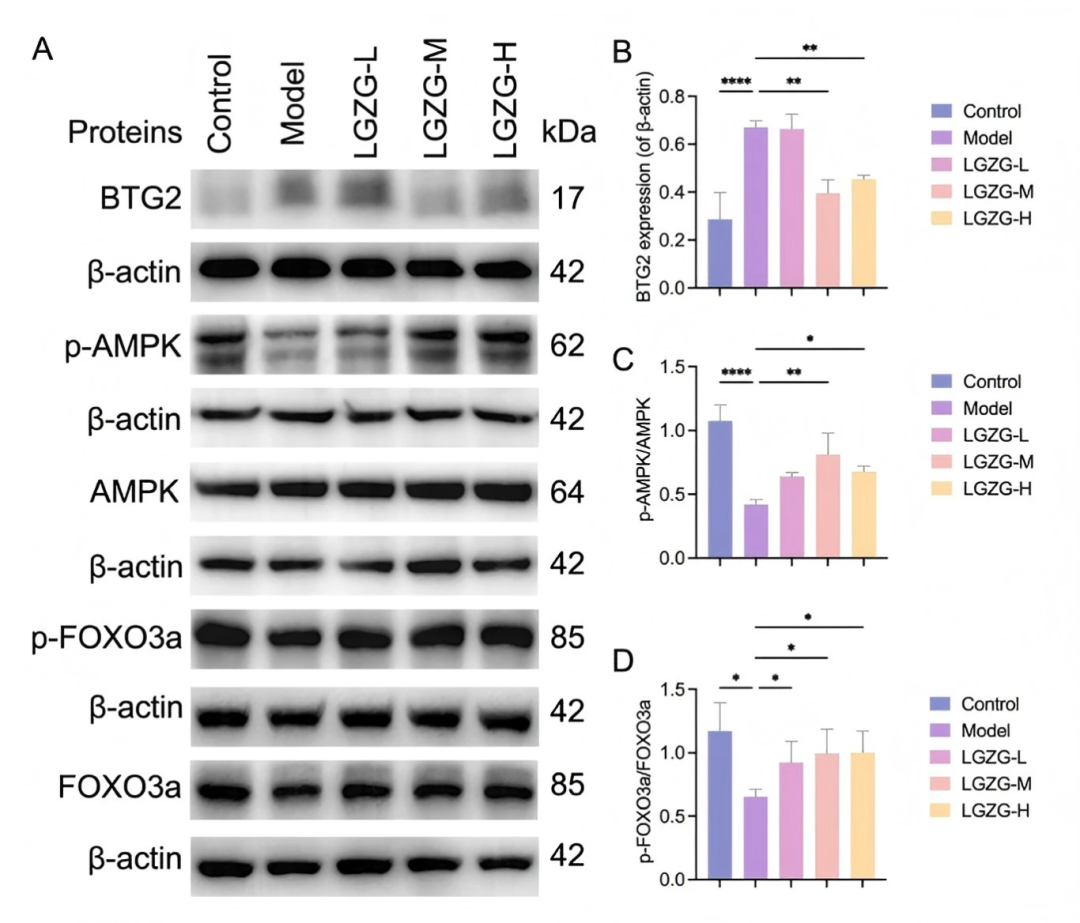
圖9. LGZGD可以通過BTG2調節AMPK-FOXO3A途徑來改善DIC
10.分子對接和MDs驗證了LGZGD的靶點
AMPK是細胞能量穩態的關鍵調節因子,激活后可增強線粒體功能,從而發揮心肌保護作用。FOXO是FOXO轉錄因子家族的重要成員,也是AMPK的下游靶點,在線粒體動力學和自噬穩態中發揮關鍵作用。AMPK激活調節FOXO3a在Ser413位點的磷酸化,促進其核轉位。該級聯反應促進能量產生,恢復線粒體功能,減輕心肌損傷,其中FOXO3a是FOXO家族中研究最為廣泛的成員。此外,轉錄組學分析顯示,BTG / TOB家族成員BTG2的表達在LGZGD干預后的心臟組織中顯著降低。高表達的BTG2可能通過抑制AMPK和FOXO3a活性,導致線粒體功能受損,加重心肌損傷,從而參與DIC病理過程。基于這些發現,LGZGD似乎通過調節BTG2靶向AMPK-FOXO3a途徑發揮治療作用。為了進一步探究LGZGD與BTG2之間的相互作用,作者進行了分子對接模擬。選取LGZGD中可能改善DI的8個核心成分,與BTG2進行分析。圖10展示了BTG2與這些化合物之間的強相互作用,其特征是氫鍵,靜電相互作用,疏水鍵和范德華力。這些化合物與BTG2的結合能均> 5 kcal/mol,表明具有顯著的結合親和力(fig10A-H)。其中,glyasperin A與BTG2的結合能最低(fig10I)。
分子對接和動力學模擬結果顯示,LGZGD的核心成分與BTG2有較強的結合親和力(圖7A-I),且模擬的復合物結構穩定(圖7J-M),進一步證實了LGZGD通過BTG2發揮治療作用的分子機制。
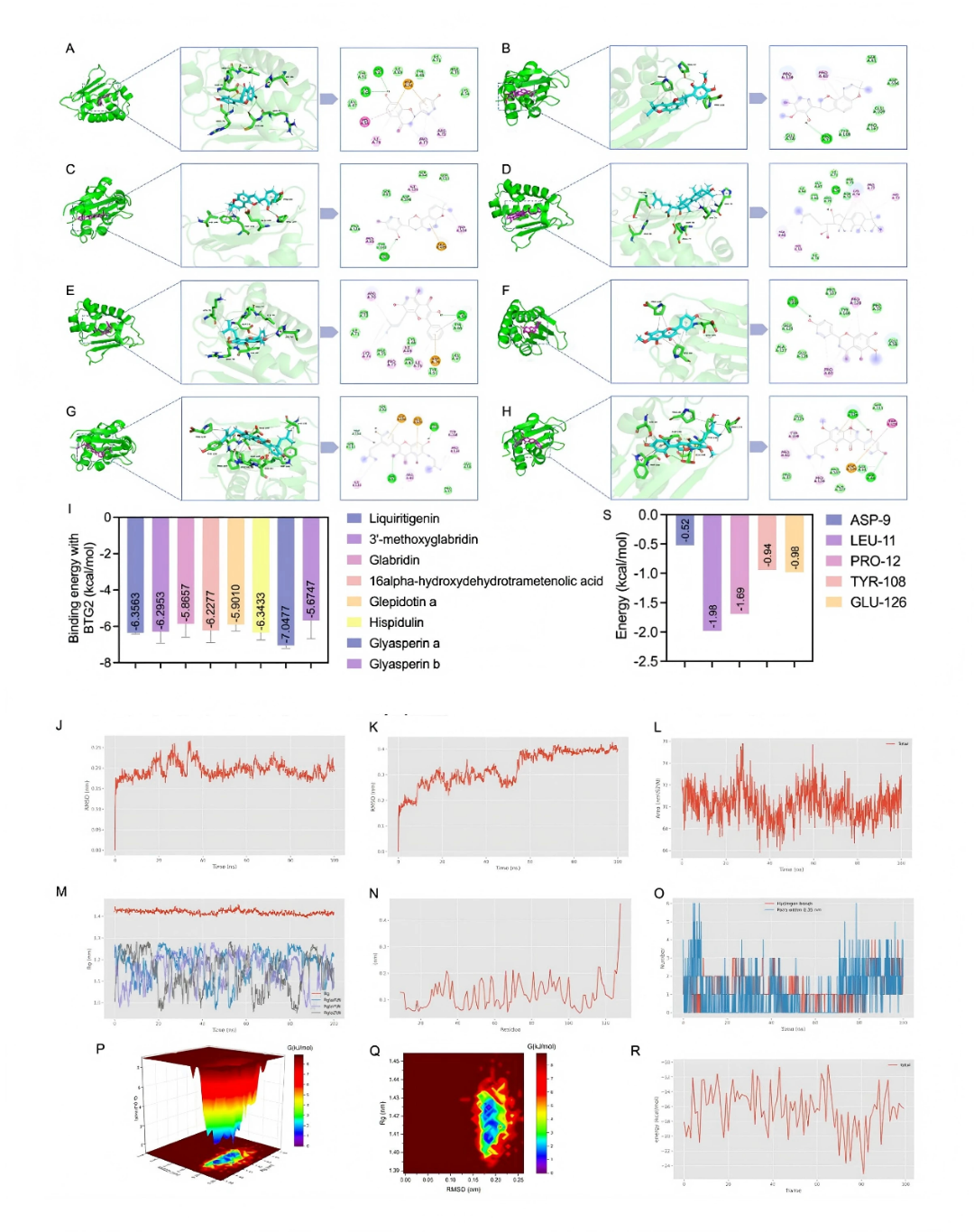
圖10. 分子對接和MDs驗證了LGZGD的靶標
本研究表明苓桂術甘湯通過靶向 BTG2 調節 AMPK-FOXO3a 通路,減輕氧化應激、炎癥和細胞凋亡,保護線粒體結構與功能,從而顯著改善阿霉素誘導的心臟毒性。
滑動查看更多:
排版:野凌
審核:三黍生物企宣部