一作解讀 | IF 10+客戶優選多糖分析組合首次公開!技術顧問感嘆:這也太會設計了……
多糖研究領域競爭激烈,如何脫穎而出,甚至能將文章發表在鼎鼎大名的Carbohydrate Polymers上?
之前我們和大家聊過一篇優秀的高分多糖文章,基本上涵蓋兩個方面:多糖結構解析和多糖活性功能的分析:
作為專研檢測服務,在多糖科研領域有著十年經驗積累的國際領先糖化學平臺擁有者,三黍生物為我們的客戶提供豐富多樣的多糖檢測服務,無論是結構研究,還是活性研究,都有靈活的選擇空間:

三黍生物多糖檢測服務,歡迎私信了解詳情!
但也因此,我們常常收到客戶的咨詢:
這么多的檢測種類,我應該怎么選?
想要發表一篇高水平的多糖研究文章,什么檢測項目適合我?
……

為了直觀地解答這個問題,我們特別邀請了剛剛在Carbohydrate Polymers發表了文章的客戶老師,首次在本欄目分享多糖的高分研究思路!
一起來看看,一篇IF 10+/Q1的多糖研究文章是如何誕生的吧~
腸道黏膜屏障是人體的第一道防線,對維持健康至關重要。腸道黏膜屏障功能的破壞與多種疾病有關,如炎癥性腸病(IBD)、關節炎、心血管疾病、代謝綜合征和精神疾病。在許多情況下,黏膜屏障的破壞往往發生在疾病表現之前。因此,調控黏液屏障的完整性是治療與腸道屏障功能障礙相關疾病的一種可行的治療策略。
胞外多糖(EPS)是微生物分泌的代謝產物,具有多種生物活性。產自Weissella cibaria的EPS可抗氧化、抗菌、促細胞活力及調節腸道微生物群。但W.cibaria EPS保護腸道黏膜屏障機制尚不明確。本研究從健康嬰幼兒糞便中篩選到一株高產EPS的W.cibaria,并對其多糖進行純化和表征,證明該新型葡聚糖以依賴于腸道微生物和丙酸的方式保護腸道黏膜屏障,從而有助于開發預防和治療與腸道黏膜屏障功能障礙相關的疾病。

W. cibaria、C57BL/6小鼠、胞外多糖
單糖組成、紅外光譜、甲基化分析、核磁光譜、潰瘍性結腸炎模型
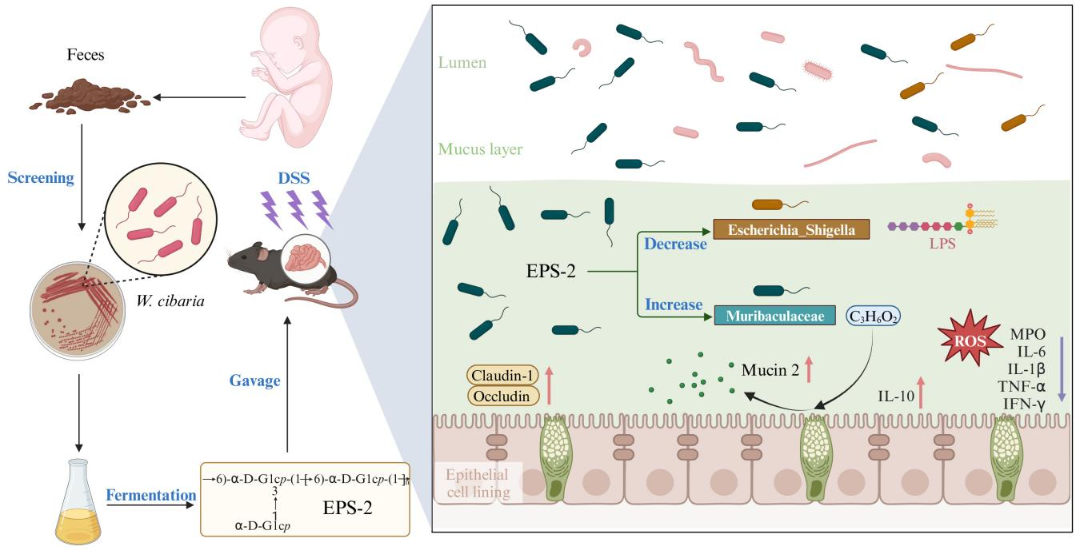
文章路線圖
1.W. cibaria 胞外多糖的制備及結構表征
W.cibaria ZMC030可以蔗糖為碳源發酵產胞外多糖。經醇沉法提取源自W.cibaria ZMC030的粗多糖,進一步經DEAE-cellulose純化得到高純度的多糖EPS-1和EPS-2,得率分別為8.6%和53.2%。鑒于EPS-1得率過低,本研究進一步研究了EPS-2的結構和功能。EPS-2的總糖含量高達98.9% ± 0.08%, HPLC洗脫圖譜顯示EPS-2為單一、對稱且狹窄的峰,表明純化所得EPS–2是均質多糖,分子量為845 kDa。單糖組成分析表明EPS-2是由葡萄糖組成的中性葡聚糖。
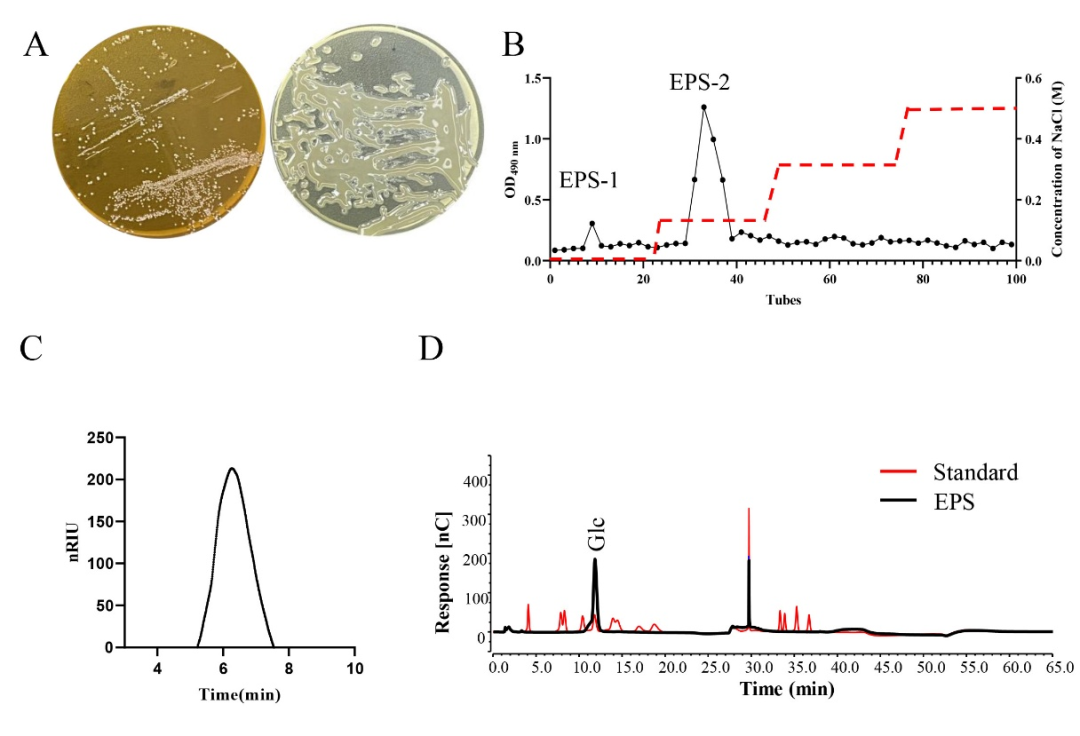
圖1 EPS-2的純化與組成分析
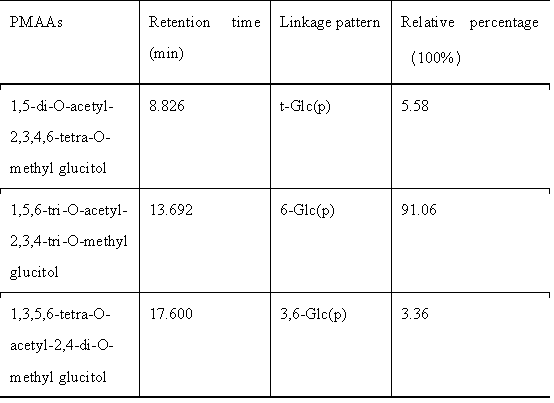
甲基化結果表明EPS-2是由葡萄糖組成,與EPS-2的單糖成分分析結果一致。分析結果顯示EPS - 2中有三種不同的衍生物。單糖殘基主要為線性的→6)-Glcp-(1→(占比91.06%),還存在一些末端的T-Glcp-(1→(占比5.58%)和分支的→3,6)-Glcp-(1→(占比3.36%)。
表1 EPS-2中糖殘基的連接模式及相應的百分比含量
一維核磁和二維核磁分析信息,推斷出該多糖主要是由→6)-α-D-Glcp-(1→和少量→3,6)-α-D-Glcp-(1→相互連接形成主鏈,支鏈主由α-D-Glcp-(1→連接在糖殘基→3,6)-α-D-Glcp-(1→的O-3位置。
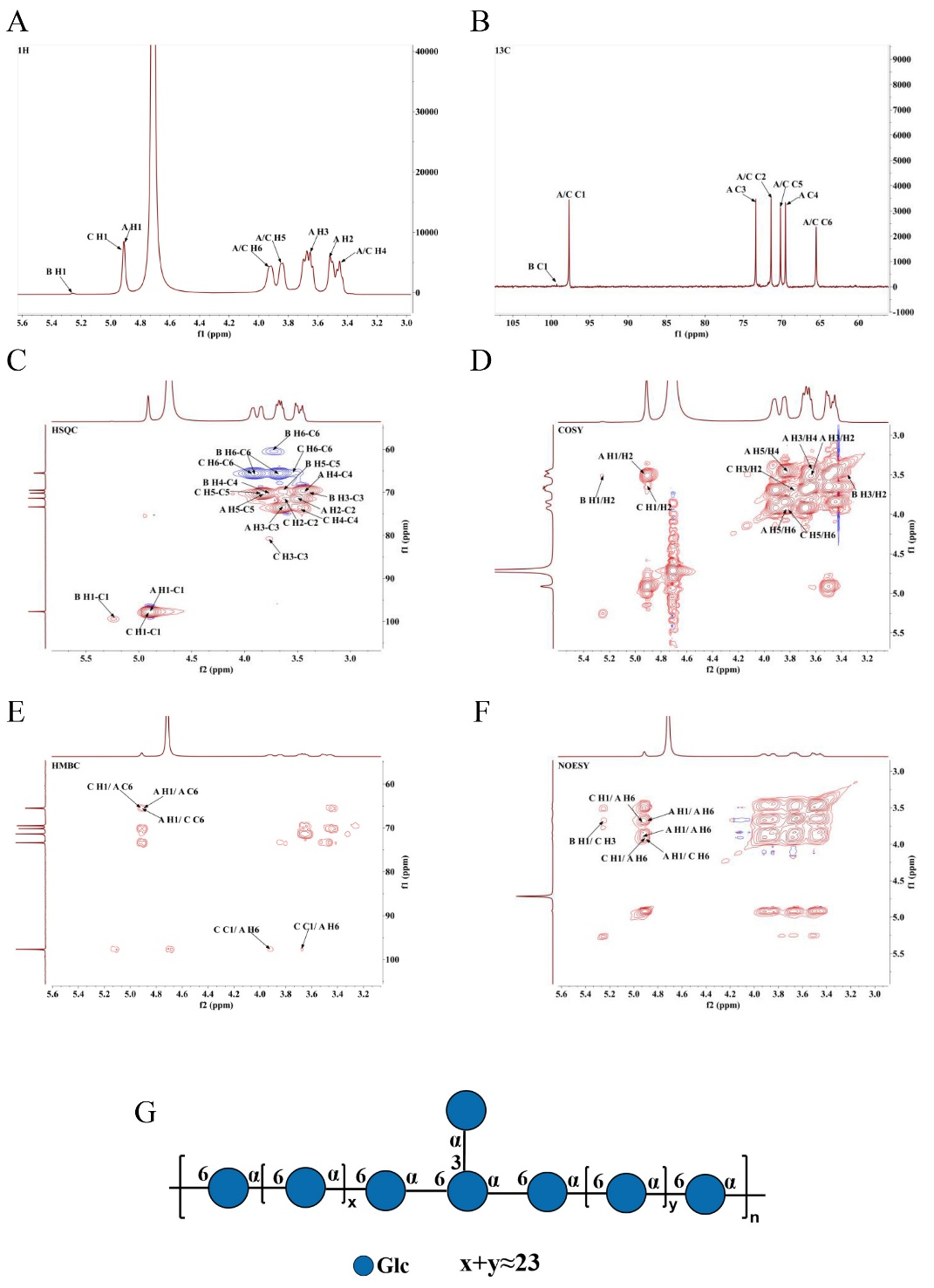
圖2 EPS-2的NMR光譜和結構式
2.EPS-2改善DSS誘導的結腸炎小鼠腸道粘膜屏障功能損傷
本研究進一步以DSS誘導的小鼠潰瘍性結腸炎(UC)為模型,探究EPS-2對腸道黏膜屏障的保護作用。結果表明EPS-2有效緩解了UC小鼠體重減輕、疾病活動指數(DAI)升高,結腸縮短和脾腫大現象。HE結果也表明,EPS-2干預后,DSS誘導小鼠的腸道上皮結構也得到顯著改善。綜上所述,EPS-2能夠有效減輕DSS誘導的小鼠結腸損傷,展現出其在保護腸粘膜屏障方面的潛力。(圖3)
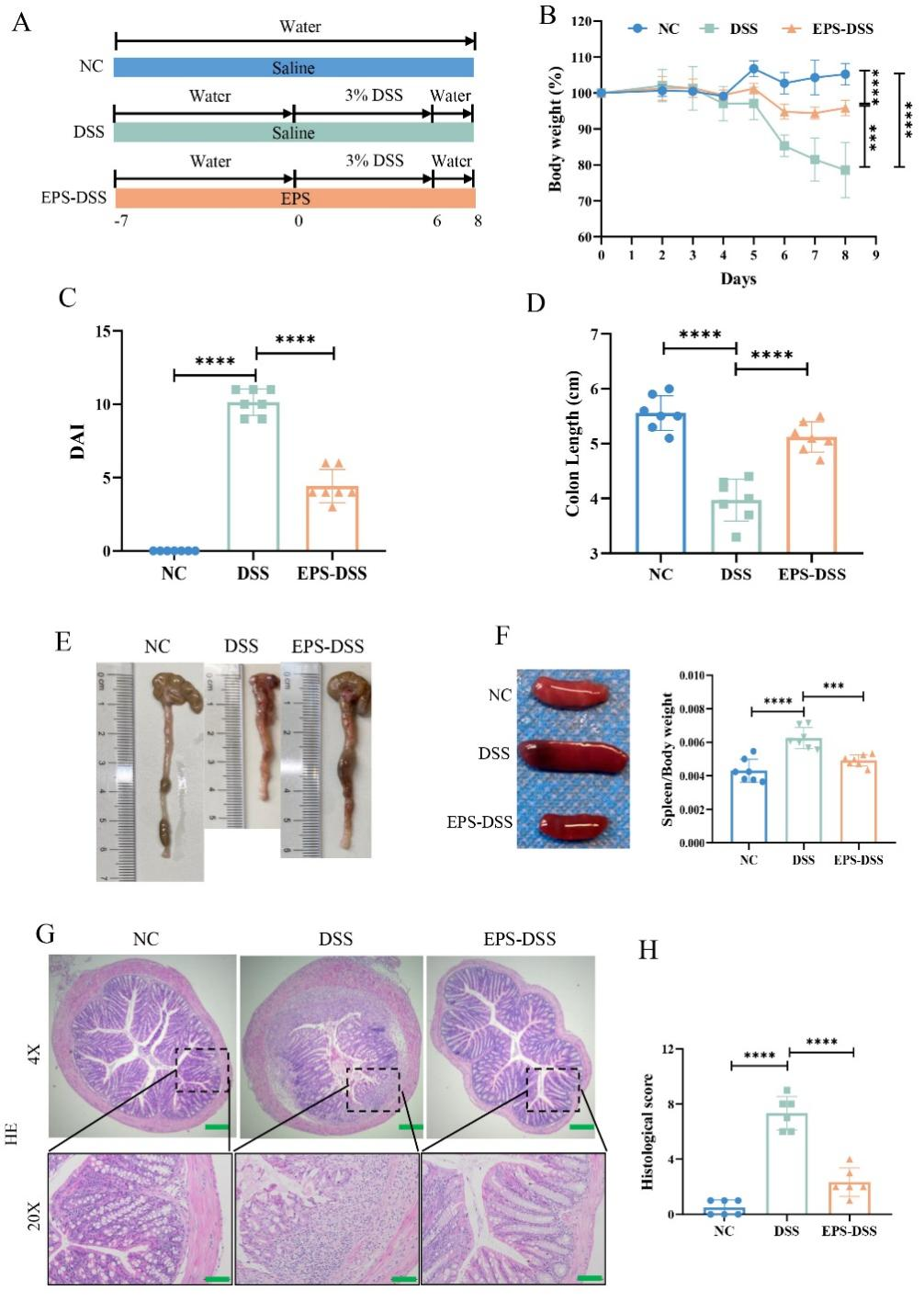
圖3 EPS-2減輕DSS誘導的結腸炎小鼠的腸損傷癥狀
黏液層和分泌黏液的杯狀細胞在維持腸道黏膜屏障的完整性和功能中發揮著至關重要的作用。杯狀細胞可以分泌黏蛋白mucin-2,維持黏液層的功能,保護腸道屏障的完整性。經EPS-2處理后,UC小鼠的結腸中杯狀細胞數量顯著增加,功能得以改善,MUC-2分泌量增加,進而促使粘液層變得更加厚實。綜上所述,EPS-2展現出了增強UC小鼠腸道黏膜屏障功能的效果。
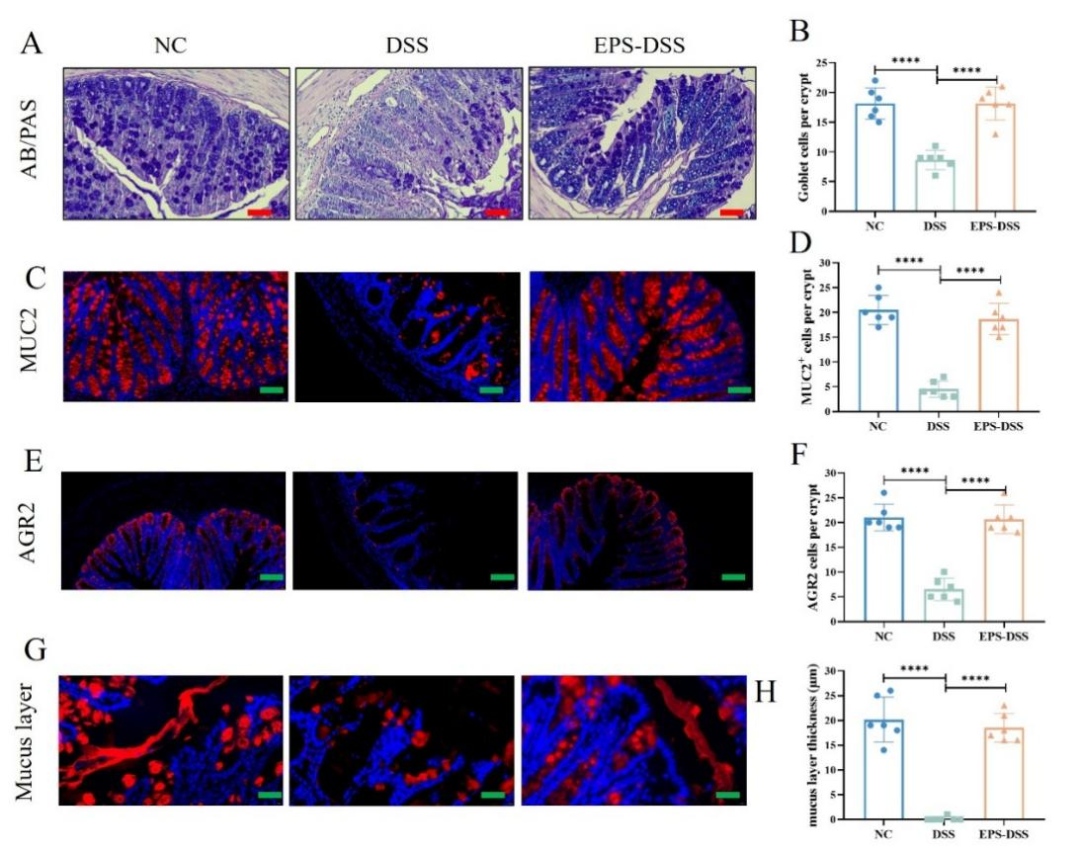
圖4 EPS-2改善結腸炎小鼠的腸道黏膜屏障穩態
3.EPS-2保護腸道黏膜屏障的功能依賴于腸道微生物及其代謝產物丙酸
本研究結果顯示,在經過EPS-2的處理后,UC小鼠的腸道微生物群多樣性得到了顯著改善。在門水平上,結腸炎小鼠中Proteobacteria和Campylobacterota的豐度更高,而Bacteroidota和Fusobacteriota相對豐度則降低。然而,EPS-2的干預有效增加了Bacteroidota的水平,并降低了Proteobacteria的比例。在屬水平上,UC小鼠中抗炎菌Muribaculaceae和Alloprevotella水平顯著下降,而產LPS的促炎菌Escherichia-Shigella和Helicobacter的豐度增加。EPS-2干預提高了Muribaculaceae的水平,并有效降低了Escherichia-Shigella的比例。該部分結果說明EPS-2改善了UC小鼠腸道菌群紊亂的現象。
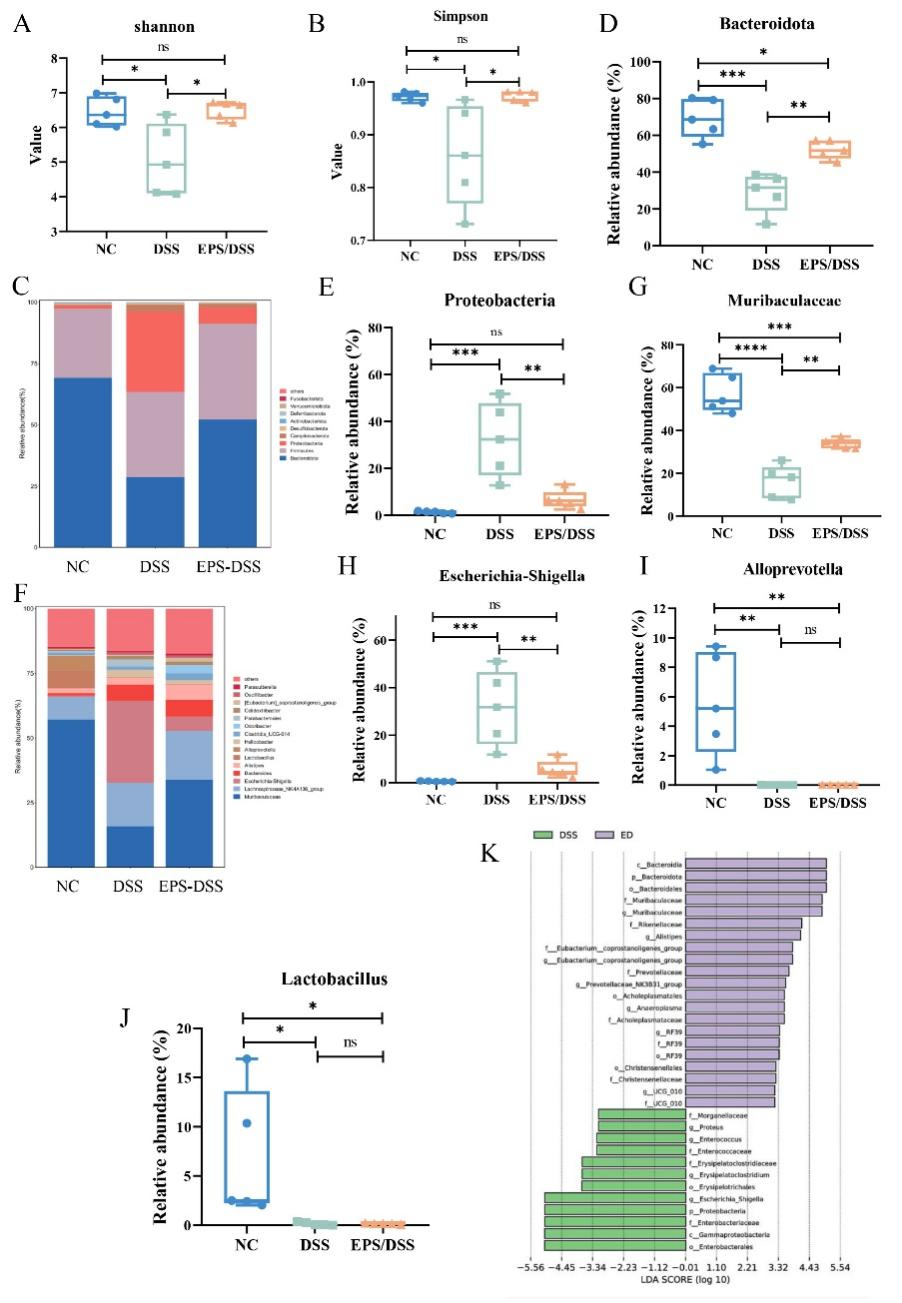
圖5 EPS-2調節UC小鼠腸道微生物
Muribaculaceae具備將多糖發酵為短鏈脂肪酸的能力,對維護腸道健康至關重要。短鏈脂肪酸靶向代謝組分析表明EPS-2處理顯著促進了UC小鼠結腸中丙酸水平的恢復。相關性分析也表明Muribaculaceae與丙酸鹽含量呈正相關,而Escherichia-Shigella和Helicobacter則與丙酸鹽含量呈負相關。經抗生素處理清除腸道微生物后,EPS-2對結腸炎小鼠腸粘膜的保護作用消失,暗示了腸道微生物在EPS-2保護腸道黏膜屏障中起到關鍵作用。丙酸鹽的干預則促進了杯狀細胞的增殖,并提升了MUC-2的表達水平,有效改善了黏液屏障的功能。綜上所述,EPS-2并不直接增強腸粘膜屏障的功能,而是通過調節腸道微生物Muribaculaceae及其代謝產物丙酸的水平,間接地介導其保護作用。
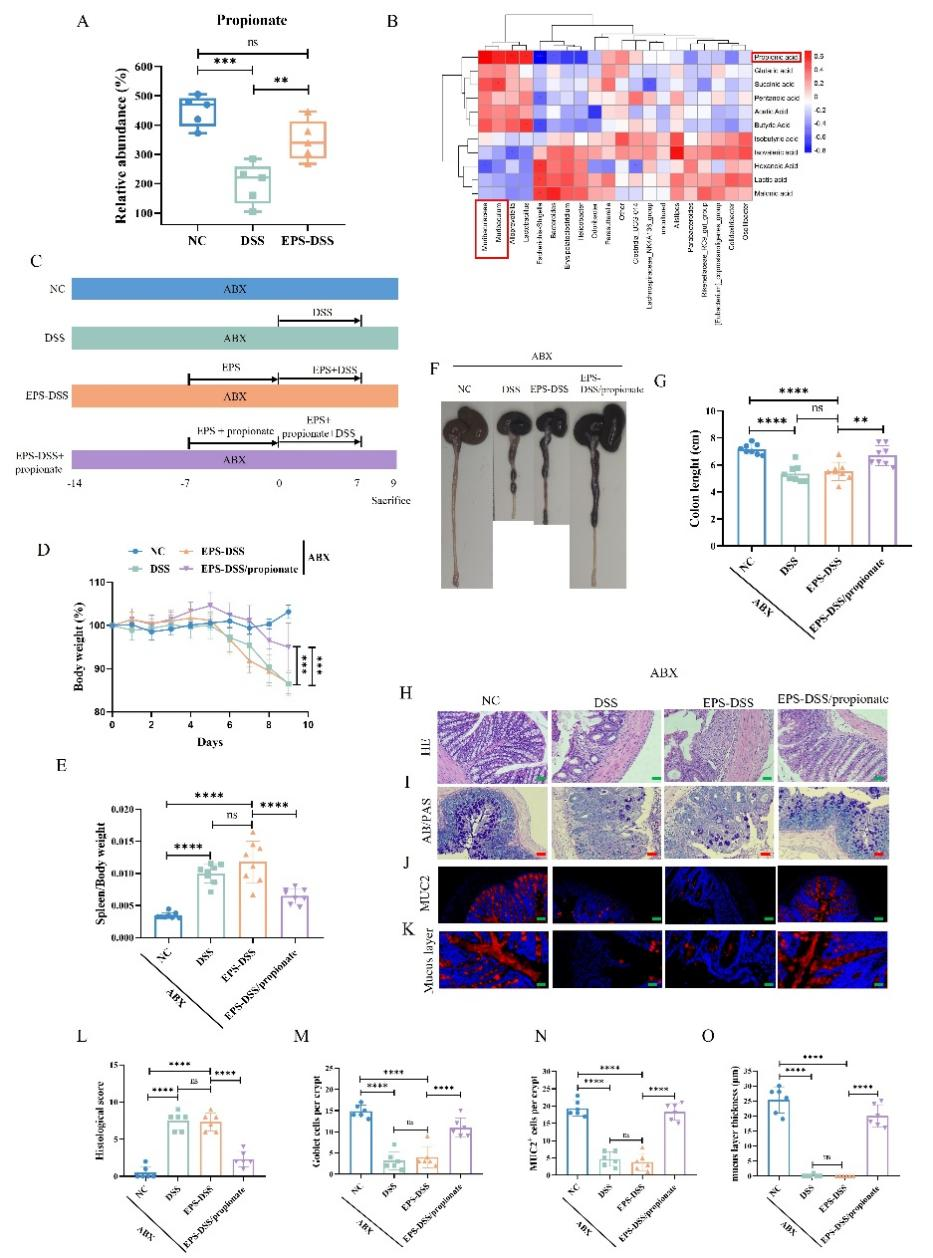
圖6 EPS-2對腸黏膜屏障的保護作用依賴于腸道微生物和丙酸
4.EPS-2增強了腸上皮屏障的穩態
TUNEL染色結果顯示,DSS組小鼠的TUNEL陽性細胞數量顯著增多,預示DSS誘導了腸上皮細胞的凋亡。EPS-02處理后則能明顯減少TUNEL陽性細胞的數量。此外,EPS-2也改善了腸道上皮屏障中緊密連接蛋白(Claudin-1和Occludin)的分布和表達。DSS導致結腸組織促炎和氧化應激水平增高,EPS-2干預后則緩解了結腸組織的炎癥和氧化應激水平。腸道黏膜屏障完整性的破壞,會促進LPS經腸屏障進入內循環,EPS-2通過降低腸道黏膜屏障的通透性,顯著內循環中LPS的水平從而減輕了系統性炎癥反應。
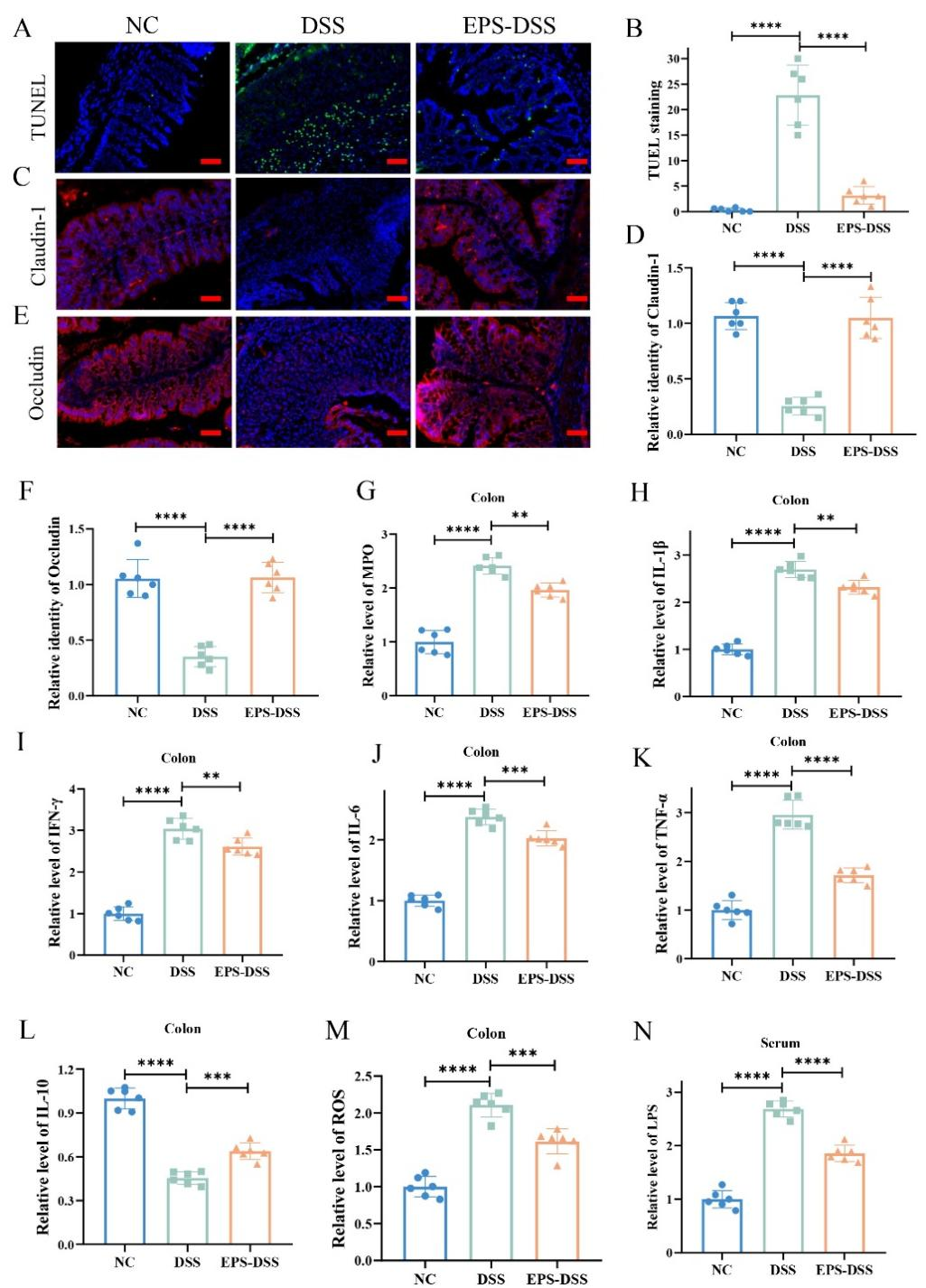
圖7 EPS-2緩解UC小鼠腸道上皮屏障紊亂和炎癥水平
5.EPS-2的生物安全性分析
細胞實驗評估了EPS-2對正常上皮細胞系NCM460無顯著毒性。此外,在連續灌胃給藥一個月后,EPS-2處理組與對照組小鼠的體重無明顯差異。進一步的生化分析顯示,EPS-2給藥后肝腎功能未見異常。HE染色結果顯示,EPS-2處理組與對照組小鼠的主要器官無明顯組織學差異。綜上所述,口服EPS-2具有較好的安全性。
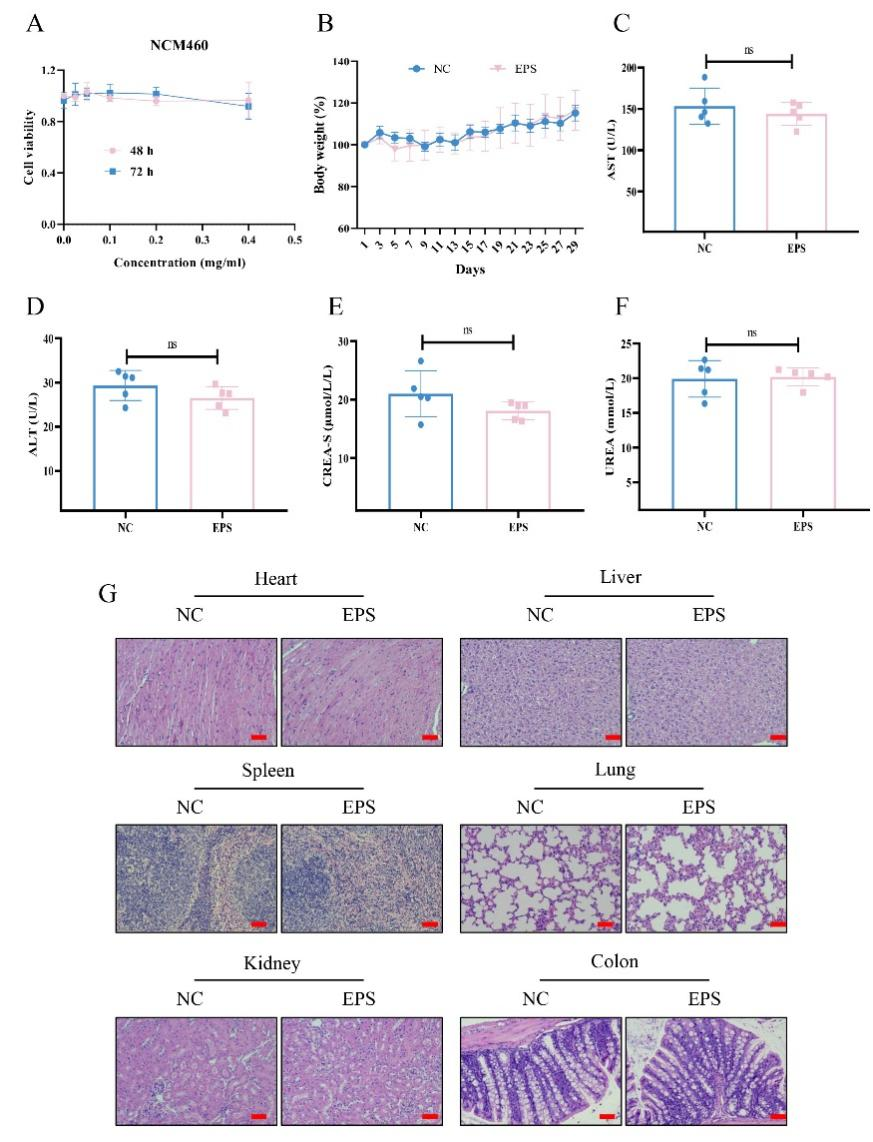
圖8 EPS-2安全性驗證
本研究利用從健康嬰幼兒糞便中篩選得到的W.cibaria ZMC030,驗證了其EPS產量以及結構表征。發現源自菌株ZMC030的EPS-2是一種新型右旋糖酐。EPS-2通過依賴于腸道微生物及其代謝產物丙酸的方式,保護腸道黏膜屏障功能的穩態。本研究證明EPS-2可作為一種新的后生元,具有應用于防治與腸道黏膜屏障功能紊亂相關疾病(如炎癥性腸病IBD)的潛力。
滑動查看更多:
排版:野凌
審核:三黍生物企宣部




