測序人人做?挖掘才是競爭力!北京林業大學11.7分文章揭秘數據利用關鍵技巧!

從測序技術誕生至今,短短幾十年的飛速發展與普及,造就了現今科研界發文章“人均測序”的現象。
人人都做測序,但對測序結果的開發利用率能達到多少呢?
面對一份測序報告,如果能進一步深入挖掘,拓展出影響因子10分以上的文章完全不是問題。例如下面這篇Science Advances的文章,就是從測序結果出發,利用經典物種楊樹,逐步推進,最終拓展為一篇思路嚴謹、結構完整的優秀文章。

背景:土壤鹽堿化對植物生長、作物生產和森林生態系統產生嚴重有害影響。植物應對鹽分壓力的能力對于生存和生物質生產至關重要,特別是在多年生樹種中。微管細胞骨架在植物應對鹽分壓力中具有關鍵功能。皮層微管可以通過快速的微管解聚和重新組裝顯著影響了鹽分壓力下植物幼苗的存活率。2025年2日,北京林業大學林金星教授課題組,在Science Advance雜志上發表了題為“Phase separation of the poplar microtubule-associated protein PagPCaP1a aids microtubule depolymerization in response to high salt”的文章,本文表征了來自雜交楊樹(Populus alba × P. glandulosa)的微管相關蛋白 PagPCaP1a,并研究了它在植物鹽耐受性中的作用。

研究材料:楊樹幼苗根系、擬南芥
技術方法:轉錄組學、遺傳轉化、RT-PCR、體外相分離
技術路線:
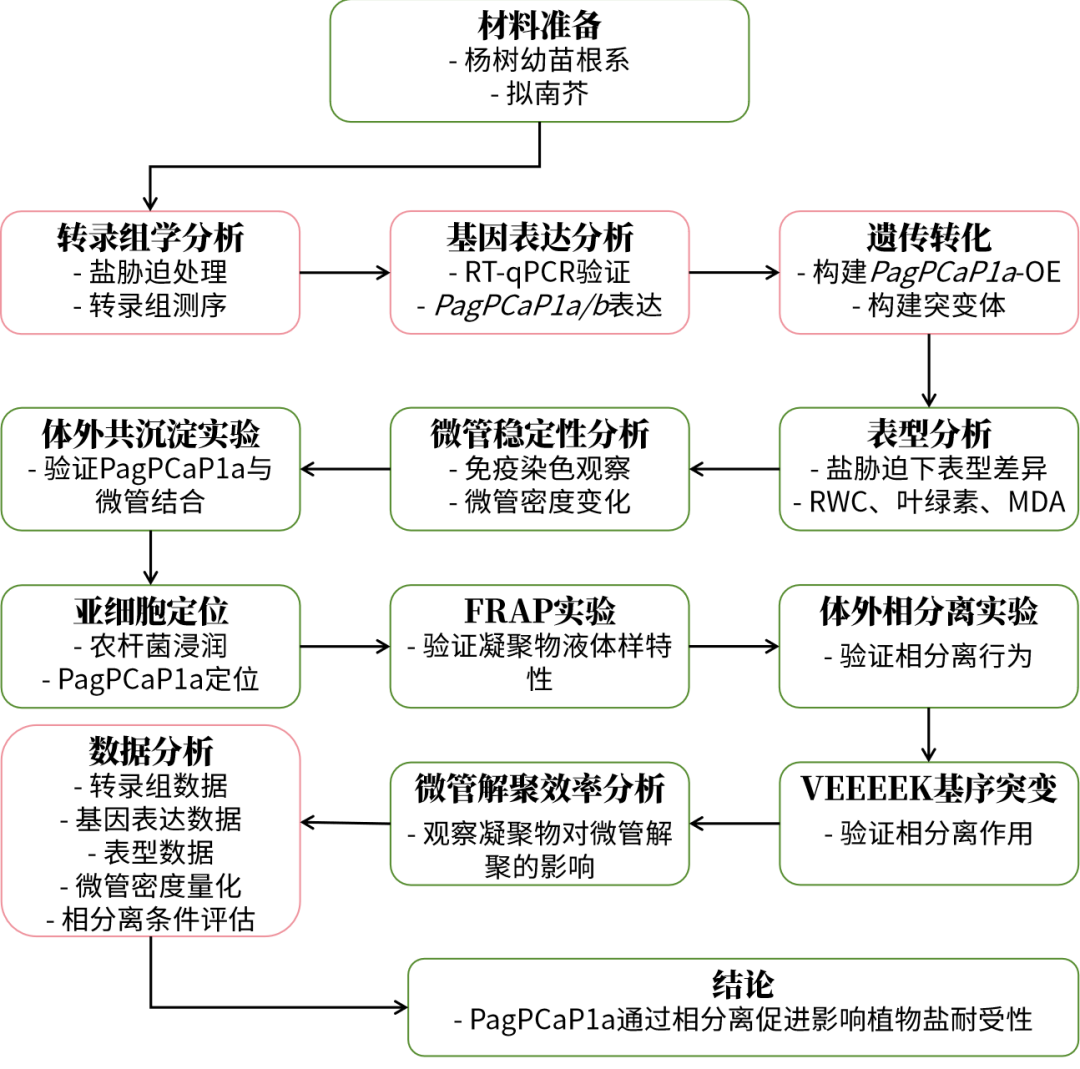
技術路線圖
1.PagPCaP1a與楊樹的鹽脅迫響應密切相關
作者用200 mM NaCl溶液灌溉組織培養生長的植物6小時、12小時、24小時,對照組植物僅用水灌溉,然后收集植物根部進行轉錄組測序及組間差異分析(圖1A、B)。其中最為重要得是GO注釋描述為編碼質膜錨定蛋白的基因,Potri.003G157100,屬于PCaP家族。楊樹基因組包含兩個PCaP1基因,分別稱為PagPCaP1a和PagPCaP1b(圖1C)。PagPCaP1a和PagPCaP1b表現出相似的表達模式,在幼葉和莖中顯示出一些表達,而在幼根和成熟根中顯示出相對較高的表達水平(圖1D)。然而,與PagPCaP1a不同的是,PagPCaP1b的表達水平在鹽脅迫下基本保持不變甚至略有下降。RT-qPCR分析驗證了這一結果(圖1E)。以上結果表明,PagPCaP1a可能參與了楊樹的鹽脅迫響應。
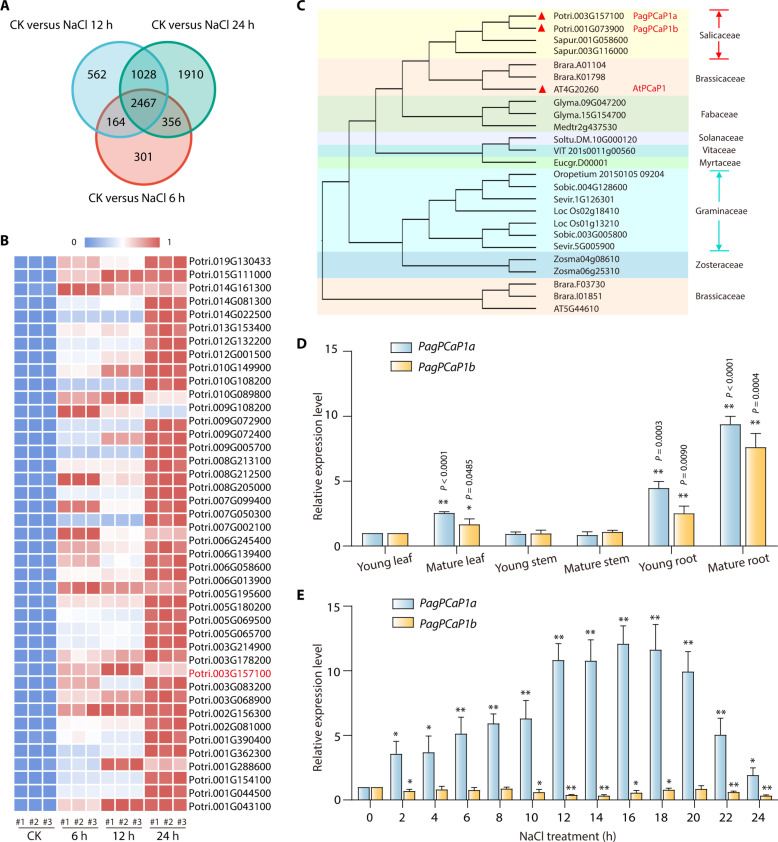
圖1 鹽脅迫的楊樹苗中PagPCaP1b的鑒定和表達分析
2.PagPCaP1b會影響楊樹的鹽脅迫適應性和微管穩定性
為了評估PagPCaP1a在楊樹中的潛在生物學功能,通過遺傳轉化實驗選擇了三個PagPCaP1a過表達系(PagPCaP1a-OE)和一個PagPCaP1a基因的突變體。用200 mM NaCl灌溉種植在土壤中的3個月大的WT、Pagpcap1a突變體和OE轉基因植物進行為期兩周鹽脅迫處理,用水作為對照。
PagPCaP1a-OE植物的葉子比WT葉子更萎蔫,而Pagpcap1a突變體植物比WT表現得更好(圖2A)。與WT植物相比,PagPCaP1a-OE植物顯示出相反的表型,表現出較低的RWC和葉綠素含量以及較高的MDA含量(圖2B至D)。同時,在擬南芥的PagPCaP1a轉基因互補系(Com#1和Com#2)的存活率低于擬南芥pcap1突變體,恢復到WT(擬南芥品系Col-0)中觀察到的水平(圖2E和F)。這些發現表明,PagPCaP1a負調控楊樹對鹽脅迫的響應,其功能在擬南芥中是保守的。
由于PagPCaP1a同源物直接調控微管,為此將15天大的楊樹幼苗浸泡在含有200 mM NaCl的液體半強度Murashige和Skoog(MS)培養基中4小時或8小時,使用轉移到含NaCl的培養基之前的幼苗作為0小時對照。通過對β-微管蛋白進行免疫染色觀察WT、Pagpcap1a和PagPCaP1a-OE#1系中根細胞的皮層微管組織。在暴露于NaCl后,所有基因型的微管密度顯著下降(圖2G)。特別是,與WT細胞相比,Pagpcap1a細胞中的微管密度下降緩慢,而PagPCaP1a-OE#1細胞中的微管密度下降更快。
為了評估PagPCaP1a對微管的生化功能進行了體外共沉淀實驗。從大腸桿菌中生產并純化了His-PagPCaP1a,并將其與預先形成的Taxol穩定微管一起孵育,His-PagPCaP1a與Taxol穩定微管混合導致大部分PagPCaP1a與微管一起在沉淀中被回收(圖2H)。這一結果表明PagPCaP1a直接結合到微管上。另外通過可視化由羅丹明標記的微管蛋白預聚合的微管,單獨或在存在PagPCaP1a的情況下,研究了PagPCaP1a對微管動態的影響。顯微鏡觀察表明,與僅觀察微管的情況相比,加入His-PagPCaP1a后存在的微管較少(圖2,I和J)。這些結果表明,PagPCaP1a作為一個微管不穩定化蛋白,參與了鹽脅迫誘導的微管重組。
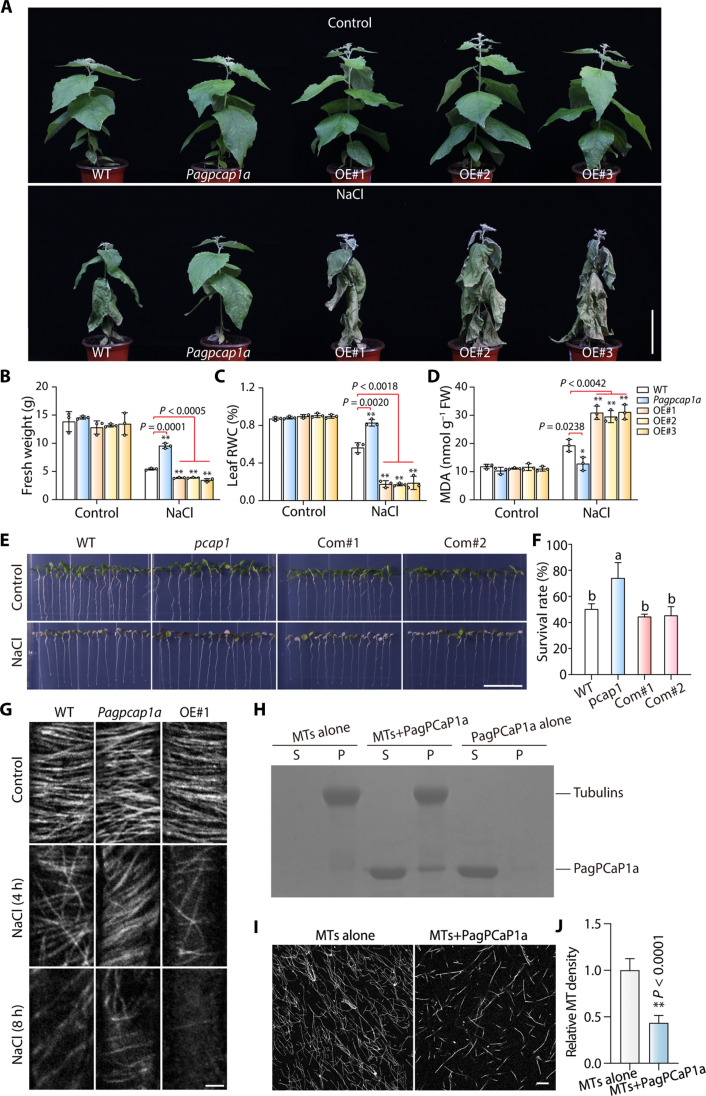
圖2 PagPCaP1b會影響楊樹的鹽脅迫適應性和微管穩定性
3.PagPCaP1a在鹽脅迫下在細胞中形成生物分子凝聚物
鑒于PagPCaP1a在鹽脅迫響應中的作用,作者評估了PagPCaP1a在正常生長條件下或暴露于鹽分壓力下的細胞中的亞細胞定位。通過農桿菌介導的浸潤將編碼PagPCaP1a-mCherry的構建體浸潤到煙草(Nicotiana benthamiana)葉中。確定PagPCaP1a-mCherry在鹽脅迫下形成誘導的凝聚物,與其在正常條件下的質膜定位相反(圖3A)。進一步研究PagPCaP1a在鹽脅迫下的楊樹中的定位,結果發現,在對照條件下,PagPCaP1a-GFP主要定位在質膜上,并在鹽處理10分鐘后迅速在細胞質中形成凝聚物(圖3B)。
為了確定PagPCaP1a凝聚物是否表現出液體樣特性,在楊樹原生質體中的PagPCaP1a-GFP凝聚物上進行了光漂白后熒光恢復(FRAP)實驗。在實驗后,PagPCaP1a-GFP迅速從未漂白區域重新分布到漂白區域(圖3,C和D),這表明這些凝聚物具有液體樣狀態。此外,PagPCaP1a-GFP在轉基因擬南芥proAtPCaP1:PagPCaP1a-GFP/pcap1互補幼苗的根細胞中暴露于鹽處理后迅速在細胞質中形成凝聚物(圖3,E和F),這些凝聚物在FRAP分析下也表現出類似的液體樣特性(圖3,G和H)。總之,這些觀察表明,PagPCaP1a蛋白在響應鹽脅迫時在體內形成具有液體樣特性的凝聚物。這些數據表明,PagPCaP1a蛋白可以形成動態的凝聚物,這種行為可能與液-液相分離(LLPS)有關。
為了確定鹽誘導的PagPCaP1a凝聚物形成是否依賴于Ca2+,在將proAtPCaP1:PagPCaP1a-GFP/pcap1轉基因幼苗暴露于200 mM NaCl之前,先用300 μM BAPTA-AM(一種可透過細胞的Ca2+螯合劑)預處理30分鐘,單獨或在存在BAPTA-AM的情況下暴露于NaCl。暴露于鹽脅迫后,BAPTA-AM大大損害了PagPCaP1a凝聚物的形成(圖3,I和J)。類似地,鈣通道阻斷劑LaCl3抑制了根細胞中PagPCaP1a凝聚物的形成(圖3,K和L)。這些結果表明,鹽誘導的[Ca2+]cyt升高在體內PagPCaP1a凝聚物的形成中起著關鍵作用。
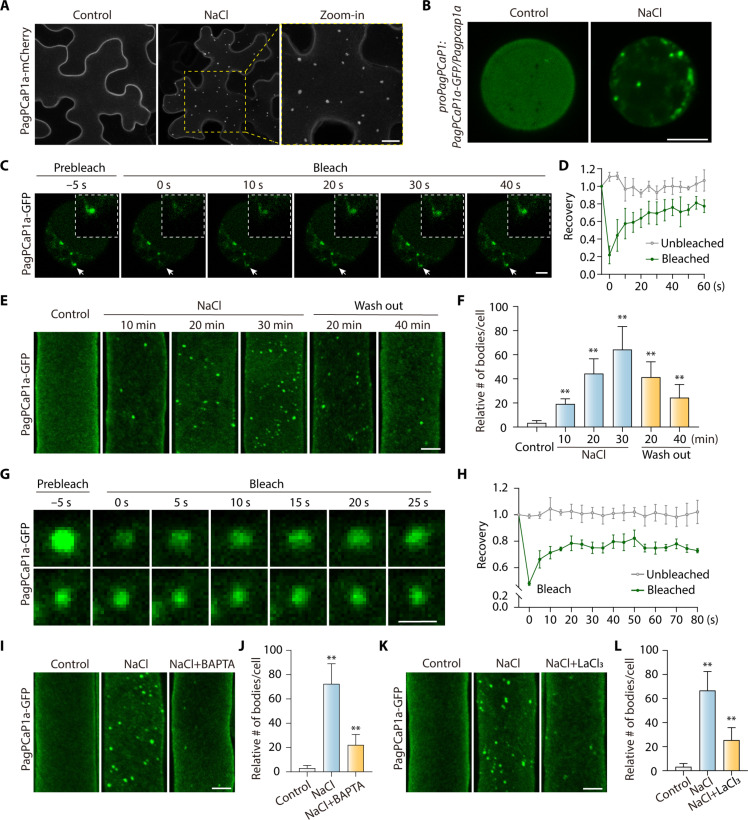
圖3 PagPCaP1a響應鹽度脅迫而經歷可逆和動態凝聚
4.PagPCaP1a在體外進行LLPS
內在無序區域(IDRs)在進行LLPS的蛋白質中很常見,介導生物分子凝聚物的形成。生物信息學分析表明,PagPCaP1a很可能含有IDRs(圖4A)。在室溫下在有或沒有NaCl的情況下孵育純化的重組PagPCaP1a-GFP,沒有任何樣本顯示出蛋白質溶液的濁度。在反應中加入了CaCl2形式的Ca2+產生了指示LLPS的濁溶液(圖4B)。為了確認Ca2+在PagPCaP1a相分離中的作用,在存在NaCl或CaCl2的情況下進行沉淀實驗,通過離心分離可溶部分和凝聚相(沉淀),隨后進行SDS-PAGE和考馬斯亮藍染色,確定了加入Ca2+促進了PagPCaP1a-GFP凝聚相(沉淀)的形成(圖4C)。對濁溶液的顯微鏡觀察顯示,PagPCaP1a-GFP/-mCherry形成微米級的凝聚物(圖4D)。
體外相分離實驗通過系統地改變Ca2+和重組PagPCaP1a-GFP的濃度來生成相圖,以評估促進凝聚物形成的條件(圖4E)。隨著Ca2+(0到10 mM)或蛋白質(5到150 μM)濃度的增加,形成的凝聚物更大且數量更多(圖4,F到H)。使用時間序列顯微鏡觀察到單個PagPCaP1a凝聚物的融合,形成了更大和更球形的蛋白質體(圖4I)。FRAP實驗顯示,漂白后的PagPCaP1a-GFP凝聚物的熒光信號在90秒內恢復到接近光漂白前的值(圖4,J和K)。這些結果表明,PagPCaP1a-GFP凝聚物具有LLPS所必需的動態特性。
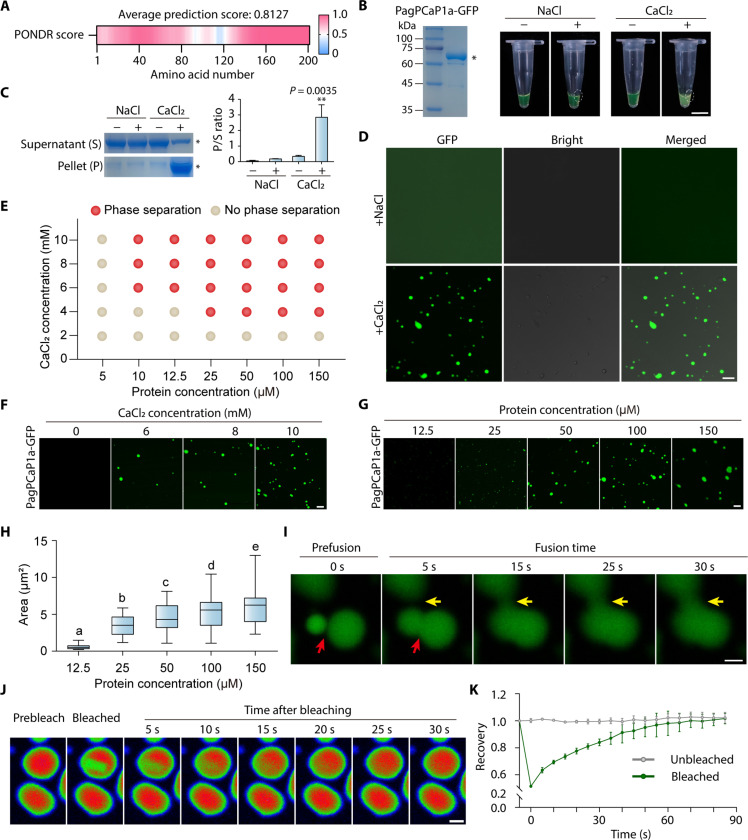
圖4 PagPCaP1a在體外進行LLPS
5.PagPCaP1a通過其VEEEKK基序部分以依賴Ca2+的方式進行LLPS
VEExK基序是一個潛在的Ca2+結合位點,并且對擬南芥中Ca2+介導的PCaP1功能至關重要。作者突變了VEEEKK基序中的三個氨基酸,創建了mPagPCaP1a變體(圖5A)。在體內的相分離實驗中,將PagPCaP1a-mCherry或mPagPCaP1a-mCherry構建體浸潤到N. benthamiana細胞中,發現PagPCaP1a-mCherry和mPagPCaP1a-mCherry在對照條件下均定位在質膜上。然而,在暴露于鹽脅迫時,PagPCaP1a-mCherry形成了可見的凝聚物,而mPagPCaP1a-mCherry則沒有(圖5B)。進一步通過在Pagpcap1a突變體楊樹獲得的原生質體中瞬時表達proPagPCaP1:mPagPCaP1a-GFP或proPagPCaP1:mPagPCaP1a-mCherry來確認這些結果(圖5C)。
此外,將proAtPCaP1:mPagPCaP1a-GFP轉基因引入到擬南芥pcap1突變體背景中(指定為mCom#1和mCom#2)。在mCom#1和mCom#2幼苗的根細胞中,即使在鹽處理條件下,mPagPCaP1a-GFP仍保持其質膜定位(圖5D),這與在楊樹細胞中的觀察結果一致。此外,proAtPCaP1:mPagPCaP1a-GFP無法補償擬南芥pcap1突變體在鹽分壓力下更高存活率的表型(圖5,E和F)。這些發現揭示了依賴Ca2+的相分離對于PagPCaP1a蛋白在幼苗響應鹽分壓力時的功能至關重要。
為了研究VEEEKK基序在PagPCaP1a相分離中的重要作用,作者檢測了mPagPCaP1a在體外的相分離。在相同濃度的Ca2+存在下,mPagPCaP1a的濁度與PagPCaP1a相比顯著降低(圖5,G和H)。對溶液的顯微鏡觀察顯示,mPagPCaP1a只能形成散亂的、不規則形狀的聚集體,因此其相分離能力大大降低(圖5,I至K),證實了Ca2+對PagPCaP1a相分離的重要作用。
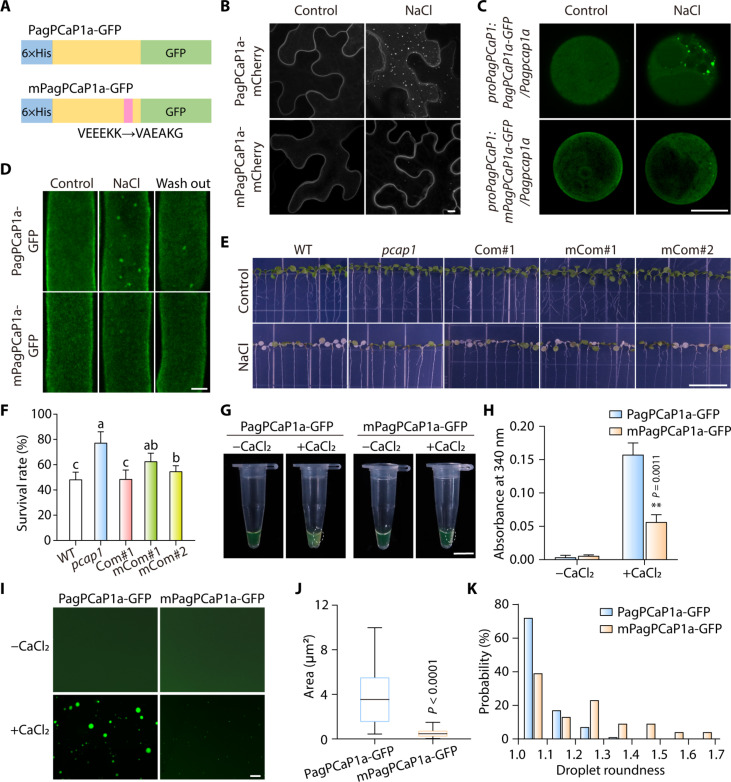
圖5 VEEEKK基序對Ca2+介導的PagPCaP1a相分離至關重要
6.PagPCaP1a凝聚物在鹽脅迫下增強微管解聚的效率
由于PagPCaP1a在鹽脅迫下使微管不穩定并形成蛋白質凝聚物,因此作者研究了PagPCaP1a凝聚物存在下微管的行為。PagPCaP1a-mCherry和MBD-GFP在本氏煙草細胞中瞬時共表達。共聚焦顯微鏡顯示,當細胞暴露于200 mM NaCl時,大多數PagPCaP1a-mCherry凝聚物與微管共定位(圖6A)。為了證實這些結果,進一步培養了共表達PagPCaP1a-GFP和mCherry微管蛋白的轉基因擬南芥植物。在這些植物中,PagPCaP1a-GFP凝聚物與mCherry微管蛋白標記的皮質微管共定位,特別是在用NaCl處理的細胞中(圖6B)。因此,PagPCaP1a凝聚物在鹽脅迫下定位于微管。
接下來,研究了PagPCaP1a凝聚物對微管組織的影響,方法是使用由羅丹明標記的微管蛋白聚合的微管,并將其與重組純化的His-PagPCaP1a或His-mPagPCaP1a一起孵育。在沒有Ca2+的情況下,與對照相比,PagPCaP1a或mPagPCaP1a的存在下微管的密度降低,PagPCaP1a和mPagPCaP1a之間沒有顯著差異。在Ca2+存在的情況下,PagPCaP1a存在下的微管密度顯著低于mPagPCaP1a存在下的微管密度(圖6C)。微管密度的量化表明,PagPCaP1a凝聚物在Ca2+存在下可以加速微管解聚約兩倍,與沒有Ca2+且沒有相分離的條件相比(圖6D),這表明PagPCaP1a的LLPS加速了微管解聚。總之,這些結果表明,鹽分壓力誘導PagPCaP1a的LLPS,這些凝聚物定位到微管上以促進其解聚,從而影響植物的鹽耐受性。
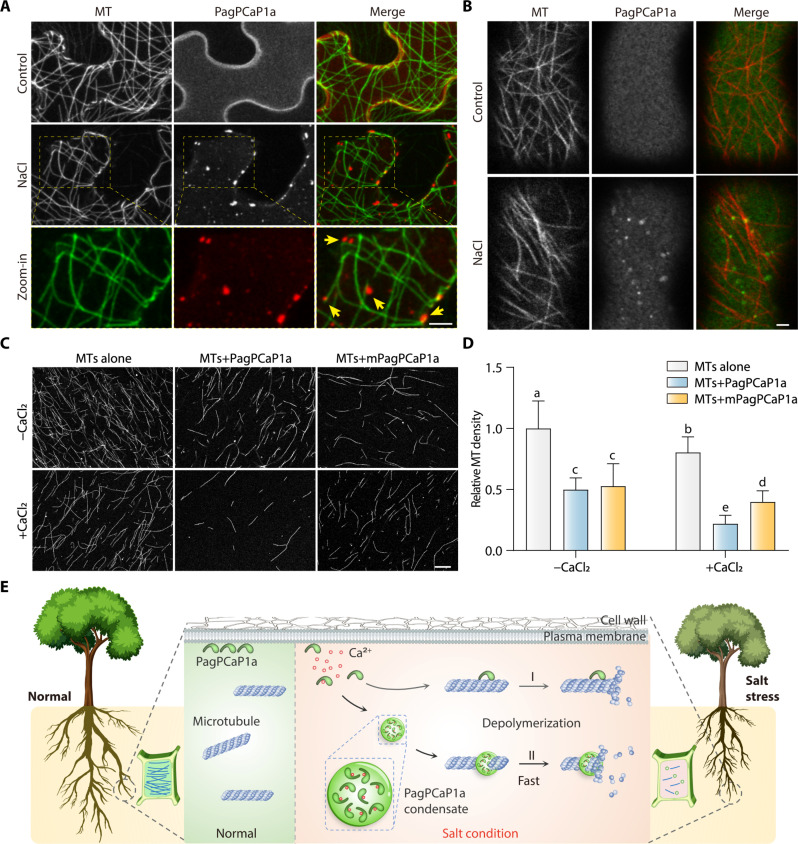
圖6 PagPCaP1a凝聚物在鹽脅迫下增強微管解聚的效率
本研究確定了雜交楊樹幼苗的鹽度脅迫反應機制。鹽脅迫誘導PagPCaP1a表達和PagPCaP1a蛋白的相分離,以鈣依賴性方式形成PagPCaP1a凝聚物。PagPCaP1a凝聚物的形成部分由蛋白質羧基末端的VEEEKK基序驅動,該基序在鹽度脅迫下迅速解聚微管。
植物遺傳轉化又稱植物基因工程,可利用重組DNA和細胞、組織培養等技術,改良植物性狀,培育優質高產作物新品種。
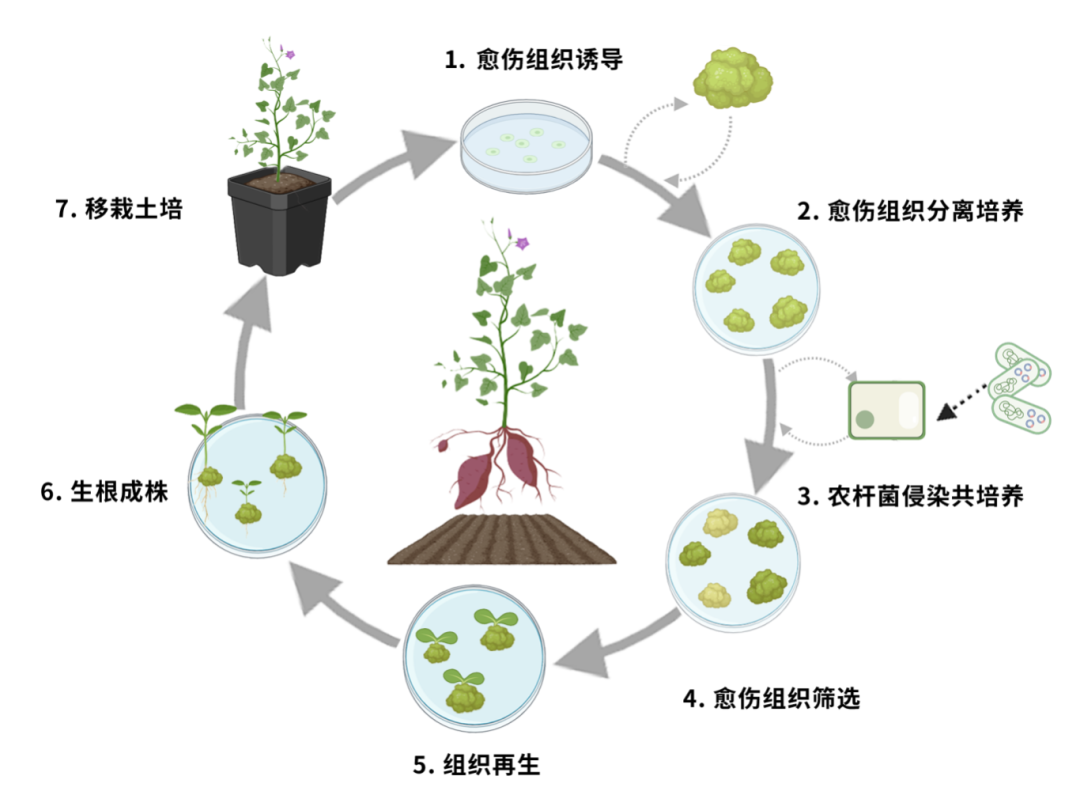
遺傳轉化技術流程
遺傳轉化手段可以為經過轉錄組、蛋白組、代謝組等多組學手段篩選出的目標基因或分子,提供直觀、可靠的結論驗證。
除了上面解讀的文章外,還有很多優秀的高分文章采用相似策略,利用遺傳轉化獲得的轉基因植株進行研究。



部分相關文獻
根據網絡數據,分子育種相關國自然項目資助金額已達到18,411萬元。
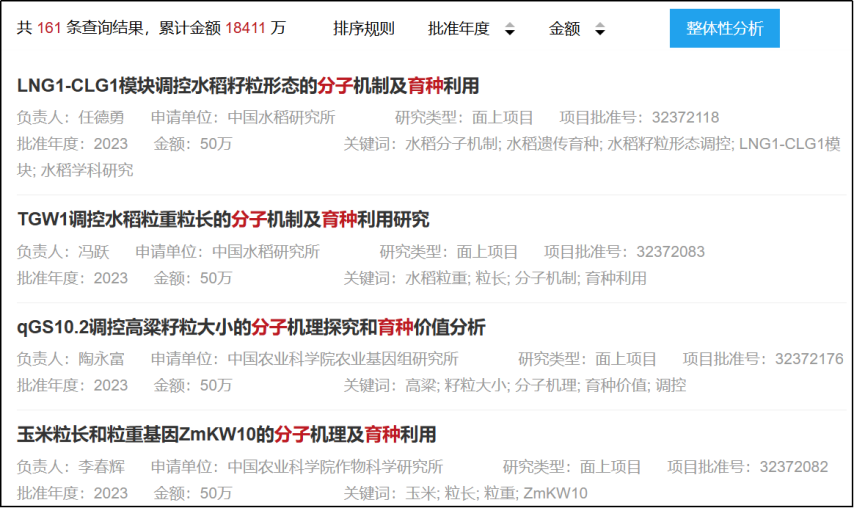
圖源:網絡
然而,作為一種發展成熟的技術,雖然轉基因植株的構建效率、質量等環節對實驗進度的影響重大,但也常常是比較容易被研究人員忽略的重點環節。
遺傳轉化的交付周期和成功率,哪個更重要?
此次遺傳轉化服務升級,我們承諾:晚交、少株必賠!
硬性交付指標無水分,保障您的每一次下單權益。
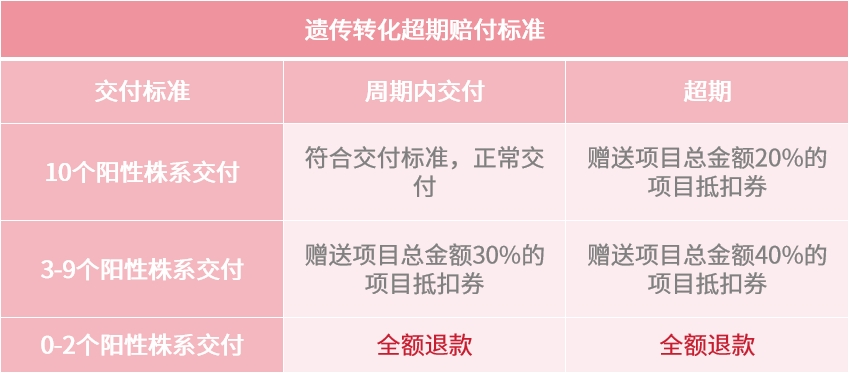
遺傳轉化項目超期賠付標準
注:
遺傳轉化產品周期為范圍,如3-5個月,超期指超出5個月。
產品周期范圍為分子實驗周期+遺傳轉化的周期。
贈送項目抵用券可用于三黍全部產品。
更多細節,歡迎咨詢詳細了解。
售中全流程透明化,您可以隨時掌握監督項目情況!
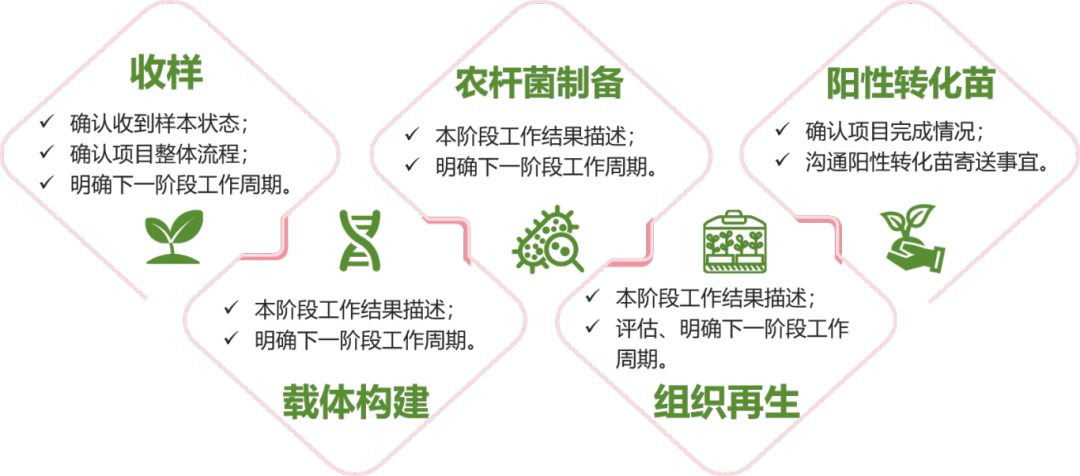
項目流程圖
作為一家深耕行業十年的公司,目前,三黍生物已擁有多個植物品種的穩定遺傳轉化體系,服務農科院、農業大學課題組、綜合大學生命學院/農學院課題組等不同研究方向多位客戶,成功發表多篇文章。
下列所有物種均適用于上述“0風險保障”條款,如果您有其他感興趣的物種,也歡迎聯系我們詳細溝通!
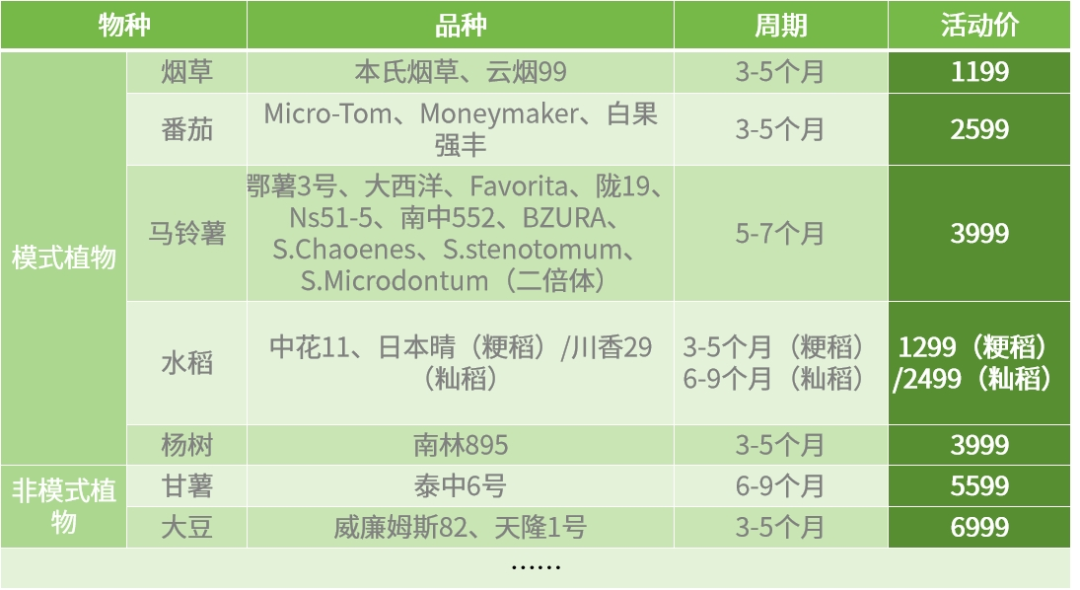
三黍生物遺傳轉化部分物種
Q1:為什么轉化周期那么長?
A:三黍的遺傳轉化屬于穩轉體系,防止因周期特別短的瞬轉手段或非標準愈傷轉化體系,導致出現基因表達不穩定、植株為嵌合體等情況,對您的項目進度造成不良影響。植物的自然生長過程較長,平均4-5個月的周期屬于正常范圍。
Q2:4個月一定能出陽性苗嗎?
A:不同基因的轉化效率、表達水平會因為植物的自身特性而有所差異。有些物種轉化較容易,有些物種較難。部分基因轉化效率不高,有些比較重要或功能冗余基因過表達后的表達量波動很大,因此需要視具體情況而定。我們會跟進轉化進度,有問題及時和您溝通。
Q3:這么長的轉化周期,這段時間我能做什么?
A:在等待遺傳轉化項目完成期間,各位老師可以根據自己的實驗進度先安排在野生型中對目標基因的表達量、功能進行檢測(介紹我們的檢測服務),也可以根據目標基因功能選擇做一些下游的轉錄組、蛋白組或代謝組分析,我們可以輔助進行課題挖掘和思路設計。
如果您還有其他問題,歡迎后臺聯系我們詳細咨詢!
滑動查看更多
高效率+高成功率
獨家穩定技術,從基因克隆到植物再生
一站式解決方案!
活動中下單任意遺傳轉化項目,即可享受:
+500元,可額外享受一次專業載體構建服務;
+800元,可額外享受一次熒光定量PCR檢測服務(含10個樣本)。
前100名咨詢客戶
可獲得
免費項目規劃和技術咨詢服務
根據您的具體需求提供個性化定制服務,讓科研更加得心應手!
滑動查看更多:
排版:野凌
審核:三黍生物企宣部




