文獻解讀 | 四川農業大學IF 10.7!雙功能ERF轉錄因子協同調控番茄果實細胞壁形成和赤霉素合成的分子機制

植物細胞壁是一種在發育過程中起著重要作用的動態結構,但調節細胞壁形成的機制尚不清楚。番茄果實的硬度與細胞壁組分的合成與降解過程緊密相關。盡管關于果實成熟過程中的軟化調控已有較多報道,但對其轉錄調控機制還缺乏深入的研究。
2024年4日,四川農業大學劉明春教授課題組在Developmental Cell雜志上發表了題為“Bifunctional transcription factors SlERF.H5 and H7 activate cell wall and repress gibberellin biosynthesis genes in tomato via a conserved motif”的文章,闡明了雙功能ERF轉錄因子協同調控果實細胞壁形成和赤霉素合成的分子機制。
番茄果實、植株
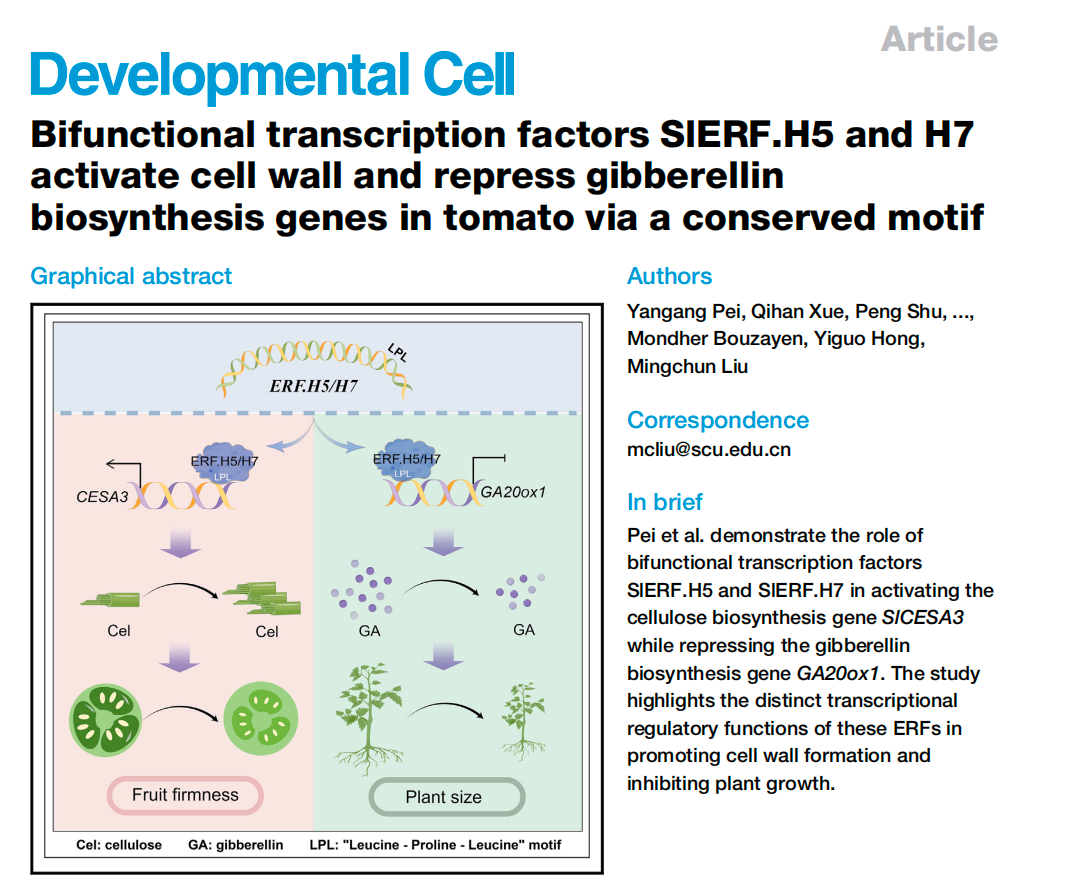
作者首先評估了SlERF.H5和SlERF.H7的表達受損是否會影響果實的硬度。觀察結果表明,敲除SlERF.H5和/或SlERF.H7的H5-KO、H7-KO和h5h7果實促進了果室凝膠的形成 ,而過表達SlERF.H5或SlERF.H7導致H5-OE和H7-OE果實的局部凝膠形成較少(圖1A和1B)。WT的果實顯示出適當的局部空腔,其中充滿了果凍樣組織,甲苯胺藍染色弱(圖1B)。然而,當SlERF.H5或SlERF.H7過表達時,局部組織染色較重,失去了明顯的果凍狀特征,顯示出厚而清晰的細胞壁(圖1B)。相比之下,KO果實局部組織完全液化,導致沒有甲苯胺藍染色(圖1B)。這些結果支持了SlERF.H5和SlERF.H7在果實發育早期和后期負調控局部果室凝膠形成。
此外,敲除SlERF.H5或SlERF.H7會導致果皮更薄,同時敲除SlERF.H5和SlERF.H7(h5h7)會導致果皮厚度下降更多(圖 1A–1C)。H5-KO和H7-KO的果皮厚度與果實半徑的比值顯著降低,而在h5h7中進一步下降,H5-OE和H7-OE的果皮厚度與果實半徑的比值顯著增加(圖1D)。此外,H5-KO、H7-KO和h5h7果實的果皮細胞層數量減少,而H5-OE或H7-OE與WT果實之間沒有顯著差異(圖1E)。然而,WT、KO和OE果實的果皮細胞大小沒有顯著差異(圖1F),表明KO和OE果實的果皮厚度的變化是由細胞層數量的變化引起的,但不是細胞的大小。由于凝膠液化和果皮厚度的變化會影響果實的硬度,本文研究了果實發育和成熟的十個主要階段的果實硬度(圖1G)。在10 DPA時,我們檢測到KO和OE品系之間的果實硬度沒有顯著差異(圖1G)。然而,從20 DPA開始,H5-KO和H7-KO果實的硬度明顯低于WT,在h5h7更明顯,而H5-OE和H7-OE果實始終保持較高的果實硬度(圖1G)。值得注意的是,此時果實開始表現出結實的表型,這與果實發育早期SlERF.H5和SlERF.H7的高表達水平一致(圖S1B)。在WT和OE株系中,當果實開始成熟后,果實的硬度開始下降,而KO果實的硬度從25 DPA開始下降(圖1G)。這些結果表明,SlERF .H5和SlERF.H7在未成熟番茄果實發育早期具有保持高硬度的功能。
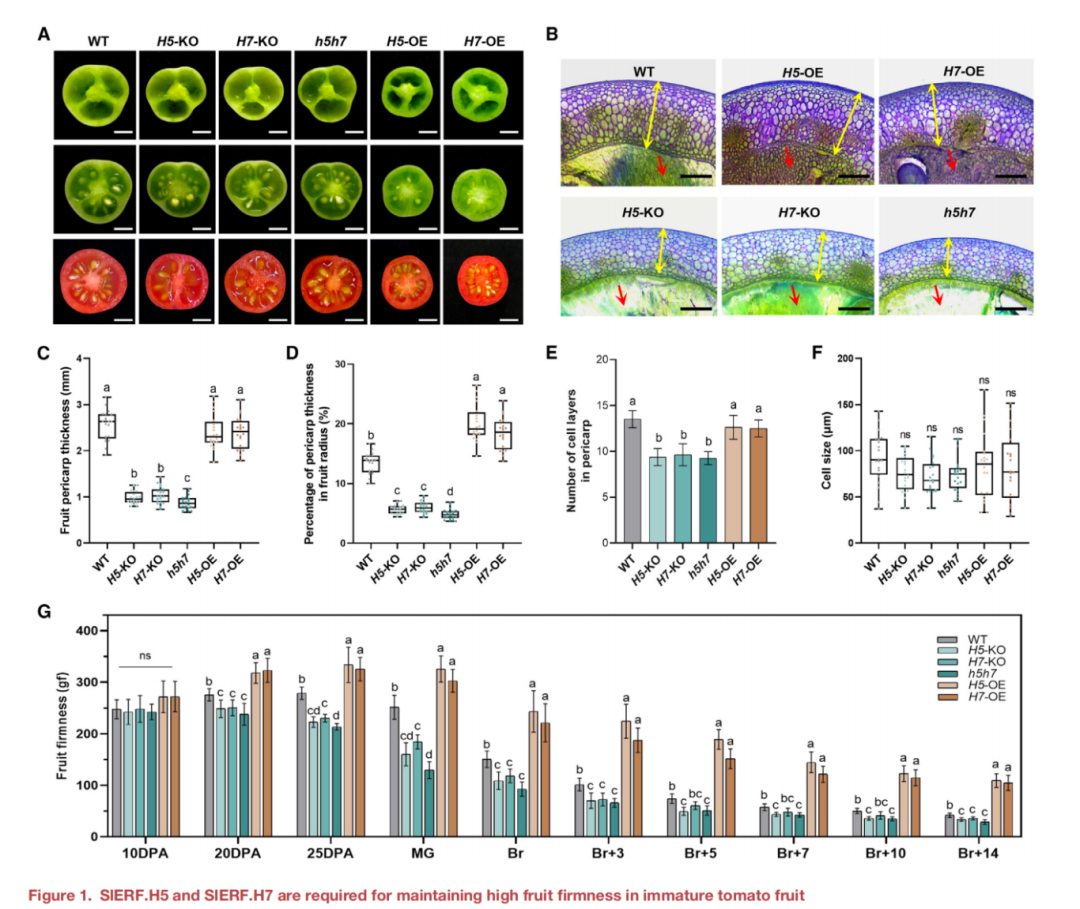
圖1 SlERF. H5和 SlERF.H7是 保 持 未 成 熟 番 茄 果 實 高 硬 度 所 必 需 的
2. SlERF.H5和SlERF.H7通過調節細胞壁的形成來調節果實的硬度
與WT相比,敲除SlERF.H5或SlERF.H7導致細胞壁明顯變薄,h5h7果實顯示出更顯著的表型(圖2a和2B)。相比之下,過表達SlERF.H5或SlERF.H7會在25 DPA時產生更厚的細胞壁(圖2a和2B)。在果實成熟過程中(Br+7階段),敲除SlERF.H5或SlERF.H7可促進細胞壁降解;而在SlERF.H5-和SlERF.H7-過表達果實中,這種降解作用減弱,這可能是果實硬度增加的基礎(圖1F和2A)。使用剛果紅專門染色細胞壁中的纖維,結果如圖2C所示,細胞壁中纖維素的熒光模式與圖2A中的結果一致。此外,還測定了WT、KO和OE植株果皮中的纖維素含量。與細胞壁的纖維素熒光相一致,H5-OE和H7-OE果皮纖維素含量顯著升高;在25 DPA和Br+7時,H5-KO和H7-KO的纖維素含量低于WT,h5h7的含量下降大于H5-KO和H7-KO(圖2D)。這些結果表明,SlERF.H5和SlERF.H7通過促進纖維素的生物合成,在番茄果實細胞壁的形成中發揮了重要作用。
三細胞連接區是降低水果硬度最重要的因素與WT相比,H5-KO、H7-KO和h5h7果實中由于細胞壁變薄而導致的三細胞連接區擴大。相比之下,H5-OE和H7- OE果實顯示的三細胞連接區,細胞壁增厚(圖2E)。此外,H5-KO、H7-KO和h5h7果實在雙細胞連接區的細胞壁明顯更薄(圖2F)。相反,H5-OE或H7-OE的果實表現出夸張的厚度,雙細胞連接區變化的細胞壁由多層組成(圖2E和2F)。為了更好地描述細胞壁組成的變化,研究還測量了半纖維素、總果膠、原果凝集素(不溶于水,已知可提高果實硬度)和可溶性果膠(水溶性,與降低果實硬度有關)這些來自不同KO和OE系的幼果(25 DPA)和成熟果(Br+7)果實的細胞壁成分。與WT在25 DPA和Br+7下的比較,KO和OE的半纖維素和總果膠含量無顯著差異(圖2G和2H)。KO系的可溶性果膠含量較高,原生果膠水平較低;與野生型相比,OE系原生果膠水平升高,但可溶性果膠水平較低(圖2I和2J)。綜上所述,SlERF.H5和SlERF.H7通過果膠調控果實的硬度,從而調節細胞壁的形成。
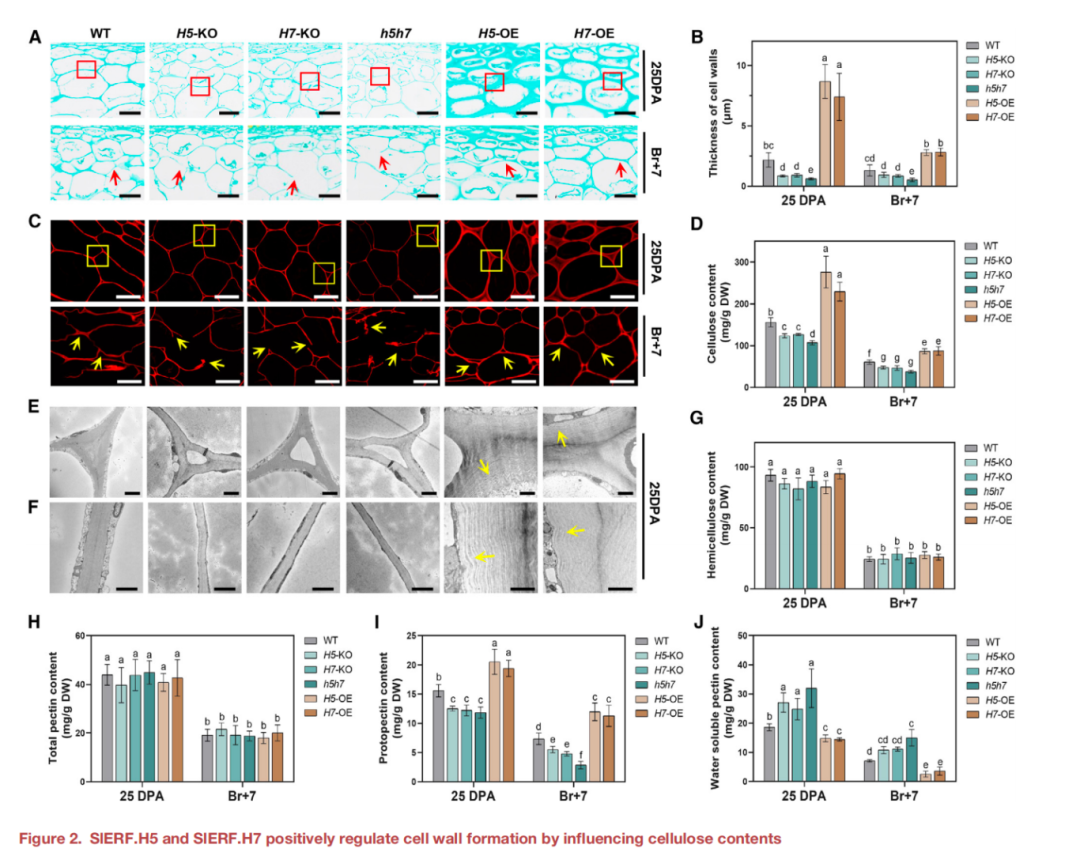
圖2 SlERF.H5和SlERF.H7通過影響纖維素含量正向調節細胞壁的形成
3. SlERF.H5和SlERF.H7調控番茄果實中CESA基因的表達
為了深入了解SlERF.H5和SlERF.H7在調節果實硬度和細胞壁形成中的作用機制,本研究進行了轉錄組測序(RNA-seq)。圖3A展示了各組間差異基因的數量。KEGG通路分析確定了多個DEGs的富集途徑包括植物激素信號轉導、苯丙素生物合成、糖代謝和類黃酮生物合成(圖3B),表明SlERF.H5參與調控多種生理過程。H5-KO和H5-OE果實中纖維素含量改變,因此關注在RNA-seq數據中CESAs的表達水平,只有一個CESA基因Solyc01g087210在H5-KO果實中下調,而在H5-OE果實中上調(圖3C)。RT-qPCR檢測顯示Solyc01g087210在H5-KO和H5-OE果實中的相對轉錄水平變化趨勢與RNA-seq一致(Figu re 3D)。這些結果表明,SlERF.H5和SlERF.H7可能調節了該CESA基因的表達。
除了Solyc01g087210之外,鑒定了擬南芥中與CESAs同源的其他8個CESA基因(圖3E)。通過系統發育分析,9個番茄CESAs命名為SlCESA1-9(圖3E),此外,還分析確定了SlCESA1、SlCESA3和SlCESA9的表達模式與SlERF.H5和SlERF.H7高度相似(Figur e 3F)。結合這些基因SlCESA1、SlCESA3和SlCESA9在KO和OE系中的表達模式,推測SlERF.H5和SlERF.H7可能調控SlCESA1、SlCESA3和SlCESA9。
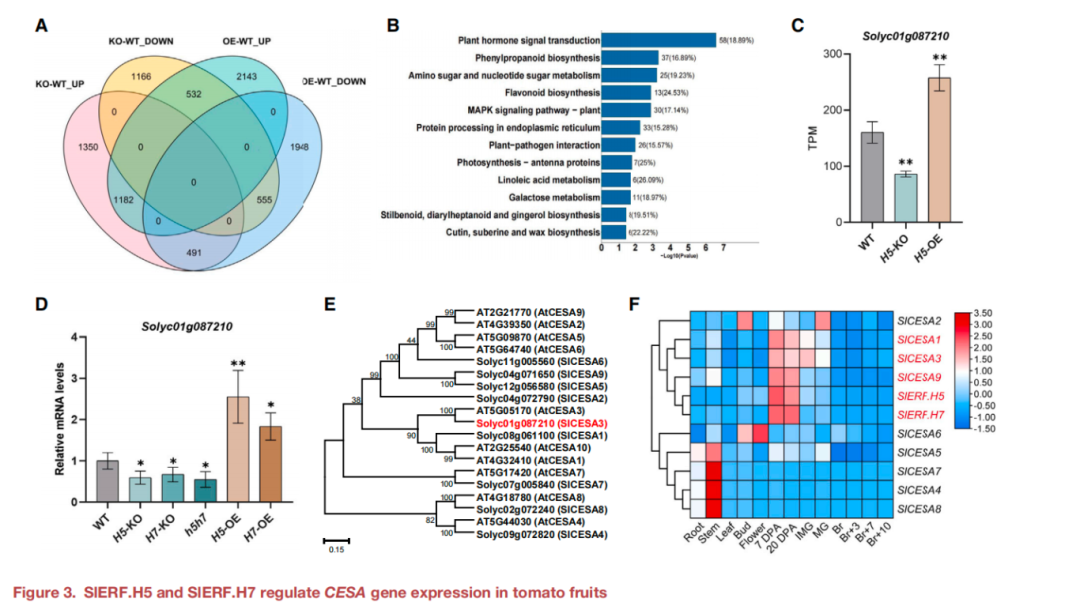
圖3 SlERF.H5和SlERF.H7調控番茄果實中CESA基因的表達
為了研究SlERF.H5和SlERF.H7對SlCESA1、SlCESA3和SlCESA9的調控機制,對這三個CESAs的啟動子序列進行了分析。雙熒光素酶實驗結果表明SlERF.H5和SlERF.H7均激活SlCESA3的轉錄,而不是SlCESA1和SlCESA9的轉錄(圖4A-C)。進一步在ChIP-qPCR檢測中,包含結合位點#1的SlCESA3啟動子片段在35S:FLAG-SlERF.H5蛋白的免疫沉淀染色質中顯著富集。重要的是,沒有觀察到這種對缺乏特定DRE序列的結合位點#2或#3或3‘非翻譯區(3'- UTR)的富集(圖4D)。基于這些數據提出SlERF.H5和SlERF.H7通過其DREs直接與SlCESA3啟動子結合。此外,還進行了電泳遷移率的檢測(EMSA),并證實重組純化的SlERF.H5和SlERF.H7在體外均與含有SlCESA3啟動子#1位點的DNA探針結合(圖4E)。
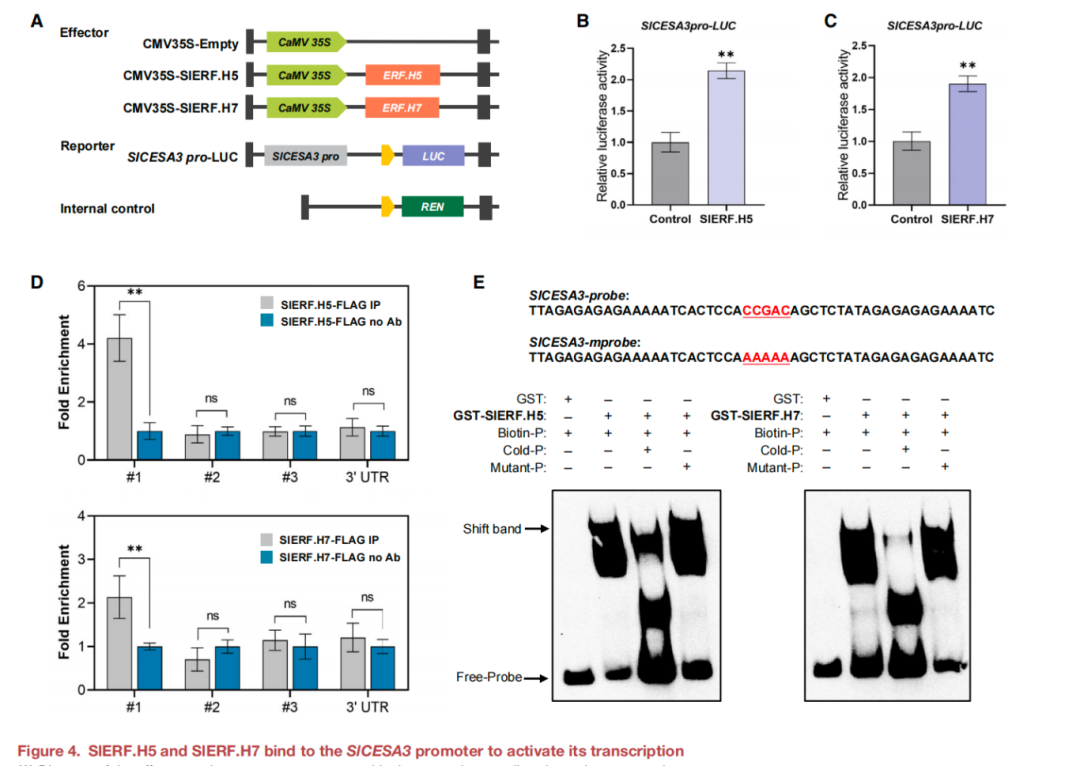
圖4 SlERF.H5和SlERF.H7結合到SlCESA3啟動子上,激活其轉錄
H5-OE和H7-OE株系均表現出矮化表型,與WT相比,植株大小顯著縮小(圖5A和5B),葉片更小(圖5C和5D)。此外,從萌發到開花的時間,與WT和KO植株相比,H5-OE或H7-OE植株的發育時間顯著延遲(圖5E)。不同的SlERF.H5過表達株系的植株大小與野生型植株相比,顯示出梯度變化(圖5F)。為了闡明這一現象,采用RT-qPCR方法分析了3個H5- OE細胞株系葉片中SlERF.H5的相對表達水平,發現SlERF.H5的表達水平與植株大小呈負相關。
在本研究中過表達SlERF.H5或SlERF.H7可以激活SlCESA3的表達, 同時也產生了矮化的植物。推斷SlERF.H5和SlERF.H7可能通過一個獨立于纖維素生物合成的途徑來調節植物的生長。為了調查這種可能性,在5周齡H5-OE和WT植株的葉片上進行RNA-seq檢測,發現H5-OE和WT植株中有1940個上調的和2484個下調的差異表達基因(DEG)(圖5J)。“KEGG”通路分析確定DEGs在多種途徑中的富集,特別是單萜、二萜、三萜、五萜和SES類物質的生物合成途徑受到影響(圖5K),提示SlERF.H5可能參與調控萜類物質的生物合成。
所有GA生物合成相關,除2個GA2ox基因外,H5-OE中的GA基因表達下調(圖5L),表明H5-OE植株中GA水平降低。為了驗證這個想法, 采用液相色譜串聯質譜(LC-MS/MS)法測定H5- OE植物中的激素含量。結果顯示, H5-OE植物中GA1、GA3、GA4等生物活性GAs水平顯著下降(圖5M)。用外源生物活性GA3處理2周齡的H5-OE植株 ,外源GA處理很大程度上恢復了H5-OE植株的縮小(圖5N和5O)。
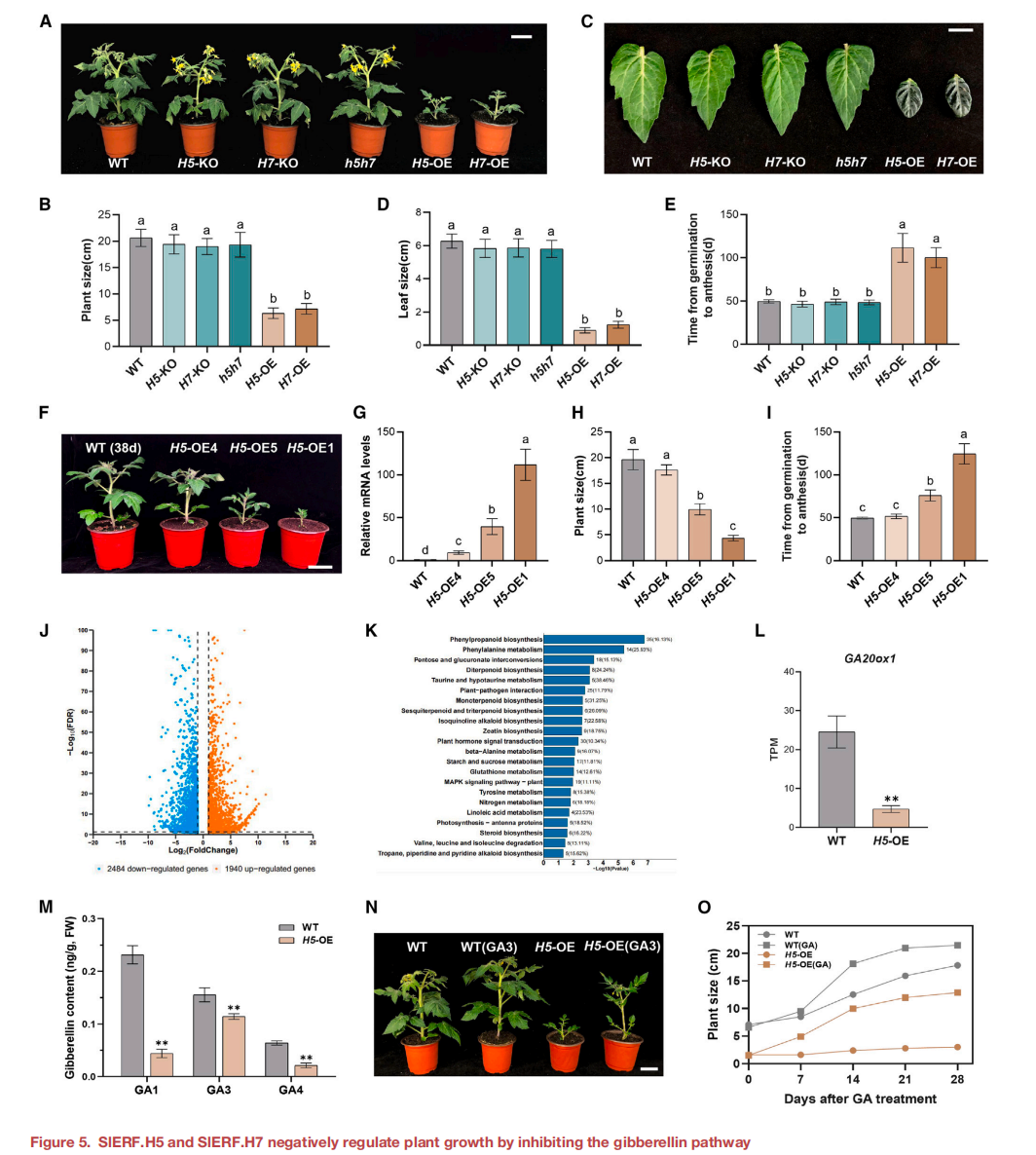
圖5 SlERF.H5和SlERF.H7通過抑制赤霉素途徑負調控植物生長
雖然發現SlERF.H5和SlERF.H7通過其轉錄激活因子功能來調節細胞壁的形成,但在OE植物中GA20ox1的表達量下調(圖6A)可能意味著它們也可以作為轉錄抑制因子。為了研究這種可能性,檢測了SlERF.H5或SlERF.H7在反激活試驗中抑制VP16介導的轉錄能力,VP16是一種從單純皰疹病毒蛋白衍生的強激活物(圖6B)。SlERF.H5和SlERF.H7融合蛋白均抑制了VP16介導的LUC活性,表明這兩種ERFs 可以作為轉錄阻遏因子(圖6B)。還通過proGAH活化實驗研究了SlERF.H5和SlERF.H7是否可以抑制GA20ox1的轉錄(圖6C)。將35S:SlERF.H5或35S:SlERF.H7效應基因與proGA20ox1:LUC報告質粒共轉染,與對照相比,顯著降低了本氏梭菌中LUC的相對活性(圖6C),表明SlERF.H5和SlERF.H7抑制了GA20ox1的轉錄。評估SlERF.H5和SlERF.H7是否直接與 GA20ox1啟動子結合,利用35S:FLAG-SlERF.H5和35S:FLAG-SlERF.H7植株的葉片和抗flag抗體進行了ChIP-qPCR。含有保守DREs的GA20ox1啟動子片段在SlERF.H5-FLAG和SlERF.H7-FLAG植物中免疫沉淀的染色質中富集(圖6D),而缺乏特異性DREs的3'-UTR沒有顯著的富集(圖6D)。此外,在EMSA中 ,SlERF.H5和SlERF.H7均直接與GA20ox1啟動子中含有DREs的DNA探針結合(圖6E)。綜上所述,SlERF.H5和SlERF.H7可以抑制其靶基因GA20ox1的轉錄,負調控植物生長。
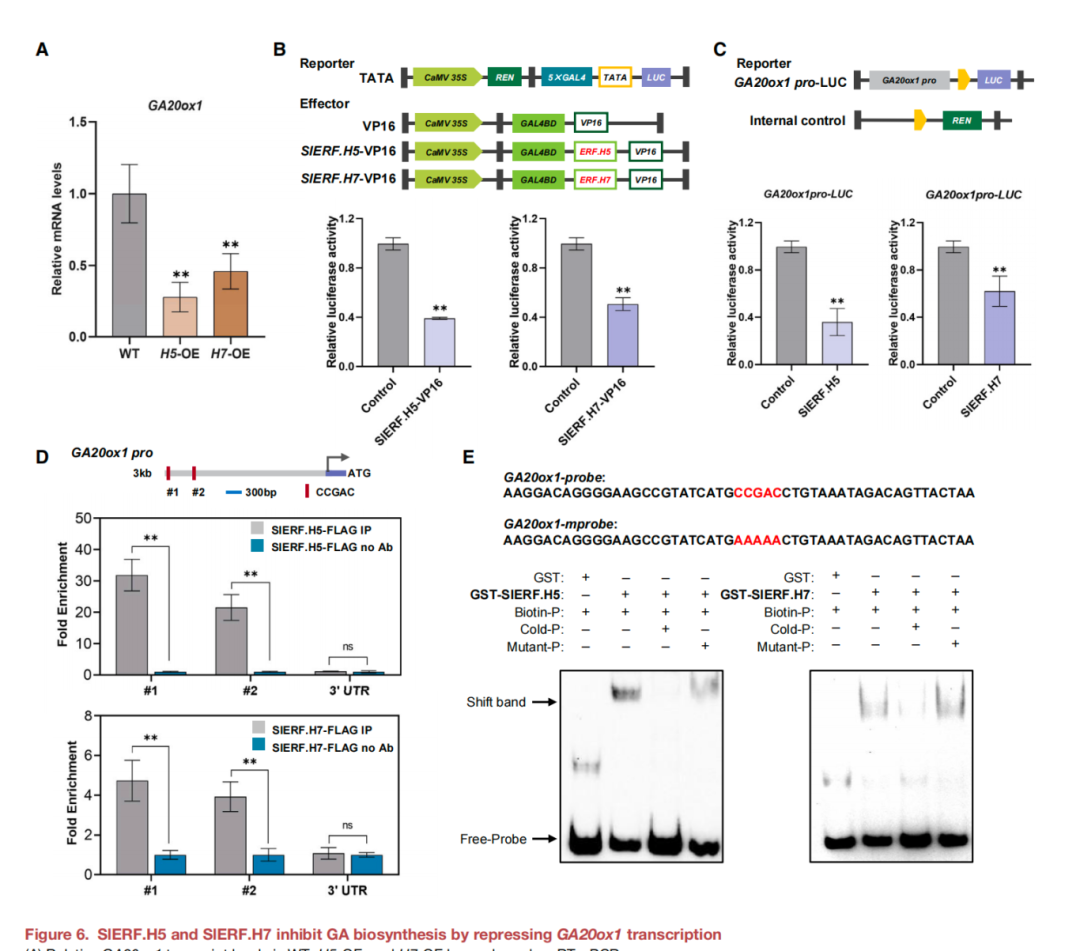
圖6. SlERF.H5和SlERF.H7通過抑制GA20ox1的轉錄來抑制GA的生物合成
基序富集分析發現了之前未知的基序LPL,其核心序列為D(E)LPD(S)L(圖7A)。為了研究LPL基序對SlERF.H5和SlERF.H7轉錄活性的影響,將SlERF.H5中的DLPDL序列和SlERF.H7中的ELPSL序列突變為AAAAA從而產生ERFs的突變體mERF.H5和mERF.H7(圖7B)。雙熒光素酶實驗結果顯示,與SlERF.H5和SlERF.H7對GA20ox1的轉錄抑制相比,用mERF.H5或mERF.H7質粒在本氏葉原生質體中轉染,失去了抑制報告基因GA20ox1轉錄的能力(圖7C),表明該基因SlERF.H5-或SlERF.H7-介導的轉錄抑制依賴于LPL基序。隨后構建了mERF.H5過表達(mH5- OE)細胞系,H5的表達是由增強的35S啟動子驅動的。mH5-OE株系中mERF.H5的轉錄水平是WT植株內源性SlERF.H5水平的50倍以上(圖7D)。與H5-OE植株所表現出的嚴重矮化表型不同,mH5-OE植株的大小與WT相當(圖7E和7F)。此外,mH5-OE植株的生物活性GA含量與WT沒有顯著差異(圖7G),表明LPL基序是SlERF.H5介導抑制GA生物合成所必需的。此外,mH5-OE的細胞壁形態在25 DPA時的果實與WT果實相似(圖7H和7I),細胞壁無顯著差異。與野生型果實相比,mH5-OE果實的厚度(圖7J)無顯著變化,mH5- OE果實中的纖維素含量并沒有顯著增加(圖7K),這表明LPL基序是SlERF.H5激活纖維素生物合成所必需的。綜上所述,這些發現支持了LPL基序對SlERF.H5-和SlERF.H7介導的轉錄至關重要的,包括纖維素生物合成基因的激活和GA生物合成基因的抑制。
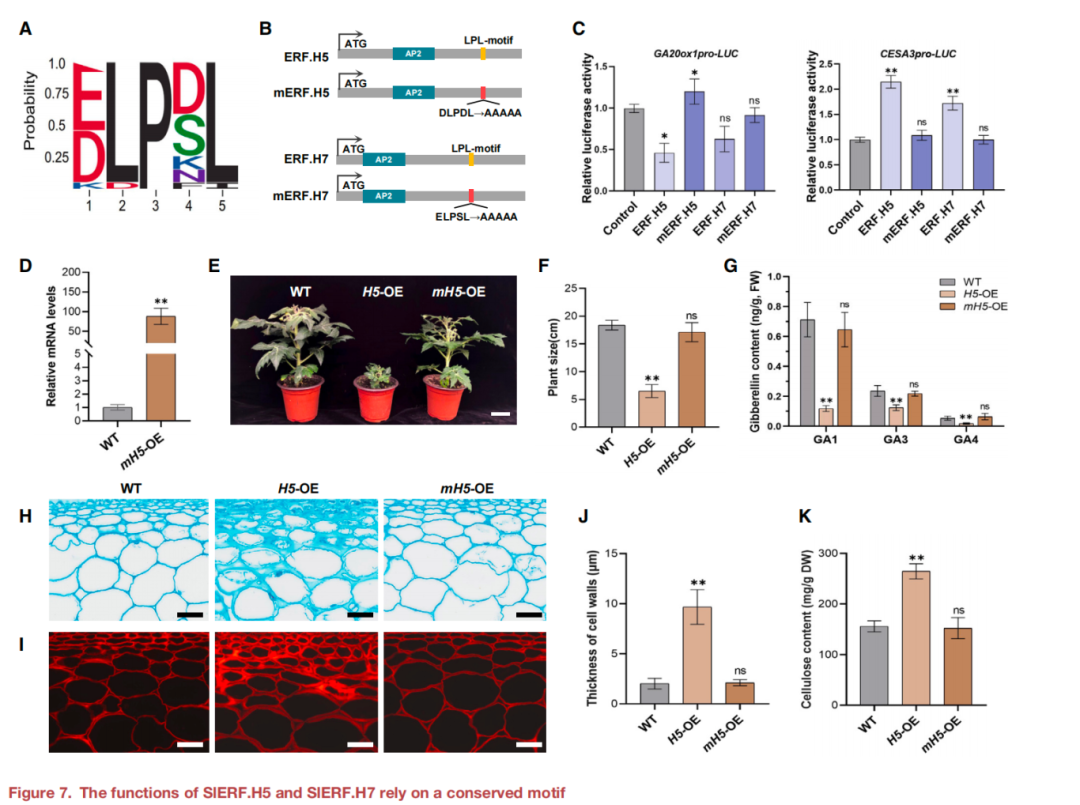
圖7 SlERF.H5和SlERF.H7的功能依賴于一個保守的基序
植物細胞壁是一種在發育過程中起著重要作用的動態結構,本研究證明了兩個轉錄體SlERF.H5和SlERF.H7以雙向的方式控制細胞壁形成和番茄果實硬度。敲除SlERF.H5、SlERF.H7或這兩種基因都會降低細胞壁厚度、硬度、在果實發育早期過程中的纖維素含量,特別是在雙敲除系中。過表達任何一個基因都會導致更厚的細胞壁和更大的果實硬度與纖維素的升高,果實中糖含量、赤霉素含量降低。進一步發現SlERF.H5和SlERF.H7激活纖維素生物合成基因SlCESA3,但抑制赤霉素生物合成基因GA20ox1。此外,在這些ERFs中發現了一個保守的LPL基序,負責它們作為轉錄激活因子和抑制因子的活性,這為了解雙功能轉錄因子如何調節不同的發育過程提供了見解。
左滑查看更多:
排版:野凌
審核:三黍生物企宣部




