

文獻(xiàn)解讀 | 多組學(xué)聯(lián)用方案用途、優(yōu)勢(shì)大總結(jié)!南京大學(xué)醫(yī)學(xué)院IF 9.4文章應(yīng)用思路分享~
多組學(xué)技術(shù)聯(lián)用,近年來(lái)幾乎是高分文章,尤其是涉及醫(yī)學(xué)、機(jī)制研究的高分文章比較常見(jiàn)的思路框架了。
的確,隨著近幾年多組學(xué)技術(shù)的不斷更新迭代,層出不窮的新技術(shù)不僅豐富了檢測(cè)對(duì)象種類,也提高檢測(cè)的速度、準(zhǔn)確度、覆蓋度……在此基礎(chǔ)上的多組學(xué)聯(lián)用實(shí)驗(yàn)方案,對(duì)于提高文章的邏輯性、可靠性和完成度都有非常大的幫助。
但這也造成了一個(gè)很多科研工作者,尤其是高分文章發(fā)文經(jīng)驗(yàn)不足的研究者常見(jiàn)困惑:
這么多種技術(shù),我該選什么?

下面,我們就為大家梳理一下幾項(xiàng)常見(jiàn)的多組學(xué)技術(shù)聯(lián)用方案和對(duì)應(yīng)的研究方向、方案優(yōu)勢(shì):
適用研究方向:疾病機(jī)制與生物標(biāo)志物篩選、病原體-宿主互作、發(fā)育生物學(xué)與細(xì)胞分化
技術(shù)聯(lián)用優(yōu)勢(shì)
功能驗(yàn)證:轉(zhuǎn)錄組反映基因表達(dá),結(jié)合蛋白質(zhì)組揭示實(shí)際功能執(zhí)行,可驗(yàn)證基因-蛋白表達(dá)的一致性或不一致性,識(shí)別轉(zhuǎn)錄后調(diào)控效率,精準(zhǔn)鎖定靶點(diǎn),通過(guò)數(shù)據(jù)互補(bǔ)增強(qiáng)結(jié)論可靠性。
適用研究方向:疾病機(jī)制、藥物靶點(diǎn)篩選、代謝調(diào)控網(wǎng)絡(luò)解析
技術(shù)聯(lián)用優(yōu)勢(shì)
因果關(guān)聯(lián):蛋白組反映功能執(zhí)行層,代謝組反映表型結(jié)果層,兩者結(jié)合構(gòu)建“調(diào)控-表型”網(wǎng)絡(luò)。
適用研究方向:宿主-微生物互作、疾病標(biāo)志物篩選、腫瘤微環(huán)境、腸道菌群功能研究
技術(shù)聯(lián)用優(yōu)勢(shì)
跨物種互作:菌群通過(guò)調(diào)控宿主轉(zhuǎn)錄組(如免疫基因)影響機(jī)體。
適用研究方向:信號(hào)通路動(dòng)態(tài)調(diào)控、疾病分型
技術(shù)聯(lián)用優(yōu)勢(shì)
精準(zhǔn)動(dòng)態(tài):修飾蛋白組捕捉翻譯后調(diào)控,常規(guī)蛋白組提供基礎(chǔ)表達(dá)水平,聯(lián)合解析明確信號(hào)通路。
除了上述介紹的幾項(xiàng)外,還有轉(zhuǎn)錄組 + 翻譯組(Ribo-seq)、微生物組 + 代謝組 + 轉(zhuǎn)錄組、scRNA-seq + 空間轉(zhuǎn)錄組等適用于不同研究需要的多組學(xué)聯(lián)用方案。
針對(duì)客戶對(duì)于多組學(xué)聯(lián)用方案的偏好,我們精選出幾套不同的多組學(xué)套餐,助力客戶春季科研沖刺:
| 檢測(cè)項(xiàng)目 | 限時(shí)活動(dòng)價(jià) |
| 16S/18S/ITS 擴(kuò)增子測(cè)序+非靶代謝組學(xué) | 399元/例 |
真核轉(zhuǎn)錄組+非靶代謝組學(xué) | 599元/例起 |
| Astral DIA蛋白組 | 559元/例 |
| Astral DIA蛋白組+磷酸化修飾蛋白組 | 1699元/例 |
下面,通過(guò)南京大學(xué)醫(yī)學(xué)院團(tuán)隊(duì)發(fā)表的一篇9.4分疾病機(jī)制研究文獻(xiàn),來(lái)具體分析一下轉(zhuǎn)錄組學(xué)與蛋白組學(xué)聯(lián)用如何為研究增加亮點(diǎn)~
慢性腎病(CKD)患者肌肉減少癥的存在與預(yù)后不良有關(guān),尤其是在晚期腎病患者和接受血液透析的腎病患者中常伴隨肌肉減少癥。為了探索CKD誘導(dǎo)的肌肉減少癥的機(jī)制,目前的研究集中在骨骼肌的分子改變上。已有一些文章報(bào)道過(guò)線粒體功能障礙等和其發(fā)病機(jī)制顯著相關(guān),但CKD引起肌肉萎縮的潛在機(jī)制尚未得到充分探索。
2025年2月,南京大學(xué)醫(yī)學(xué)院附屬醫(yī)院南京金陵醫(yī)院兒科,在Journal of Cachexia ,Sarcopenia and muscle雜志上發(fā)表了題為“Multiomics Analysis Reveals Therapeutic Targets for Chronic Kidney Disease With Sarcopenia”的文章,本文使用飲食誘導(dǎo)的CKD肌肉減少癥小鼠模型,基于多組學(xué)技術(shù)探討了疾病的發(fā)生機(jī)制,挖掘潛在的治療靶點(diǎn)。

小鼠腎臟、血清
轉(zhuǎn)錄組學(xué)、蛋白質(zhì)組學(xué)
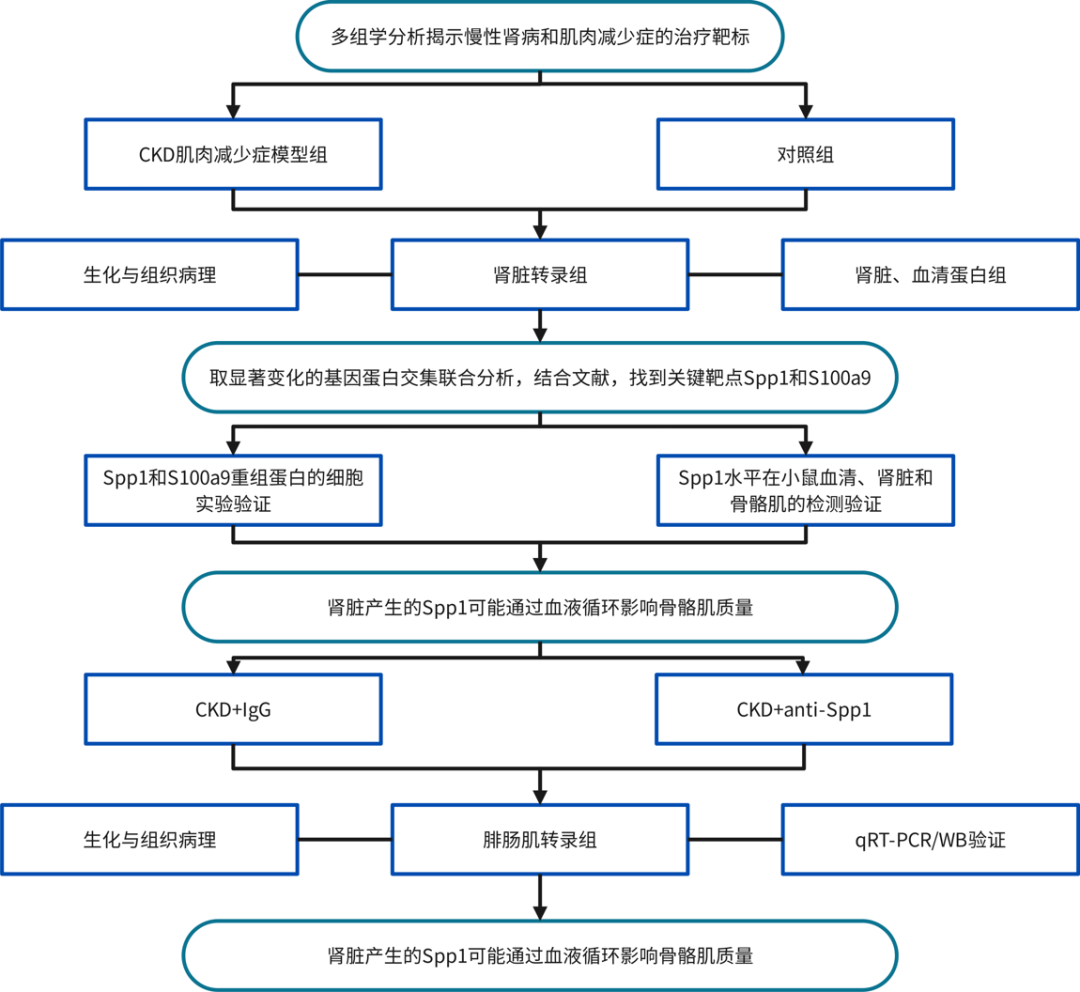
1.建立CKD肌肉減少癥小鼠模型
用0.2%腺嘌呤飲食喂養(yǎng)10周齡C57BL/6JNifdc小鼠6周后(圖1A),體重和握力逐漸下降,BUN和Scr顯著增加(圖1B,C)。腎臟病理學(xué)分析顯示CKD小鼠腎小管萎縮和間質(zhì)纖維化明顯(圖1E)。如圖1D所示,與NC組相比,CKD小鼠腓腸肌,脛骨前肌和比目魚肌的重量顯著降低。肌肉的病理學(xué)和橫截面積(CSA)分析表明,CKD小鼠的CSA顯著降低(圖1F)。結(jié)果表明,0.2%腺嘌呤顯著降低了小鼠的腎功能并增加了骨骼肌的損失。
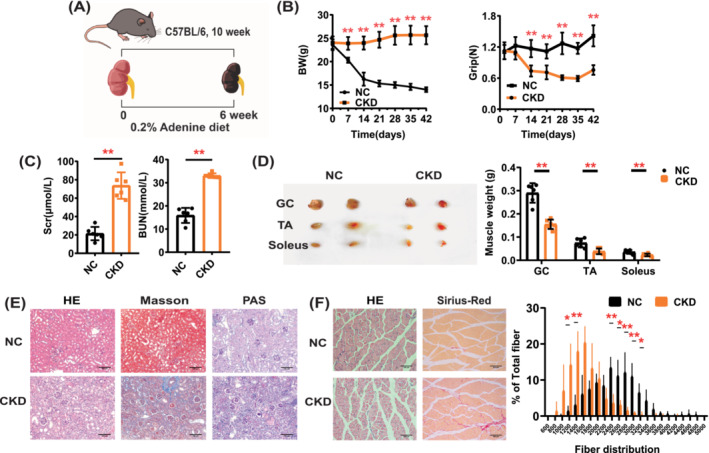
圖1 CKD肌肉減少癥模型
2.CKD小鼠腎臟轉(zhuǎn)錄組和蛋白組及和血清蛋白組分析
基于主成分分析(PCA),腎臟的轉(zhuǎn)錄組和TMT以及血清的TMT清楚地分離了CKD和NC小鼠(圖2A)。結(jié)合來(lái)自腎臟轉(zhuǎn)錄組和TMT分析的差異表達(dá)基因(DEG)/DEP,與對(duì)照組相比,CKD組中共有503個(gè)基因/蛋白質(zhì)被共上調(diào),377個(gè)蛋白質(zhì)/基因被共下調(diào)(圖2B)。隨后,共上調(diào)和共下調(diào)的蛋白質(zhì)/基因分別與血清TMT的上調(diào)和下調(diào)蛋白質(zhì)取交集,NC和CKD組之間腎臟和血清TMT中的29 DEGs/DEPs(圖2D,E)。在與圖2E中CKD腎臟和血清中表達(dá)最多的前10種蛋白質(zhì)取交集后,鑒定到6種蛋白質(zhì),包括Spp1,S100a9,Hp,Orm1,Ltf和Chil3(圖2F),為CKD誘導(dǎo)的肌肉減少癥提供了潛在的治療靶點(diǎn)。
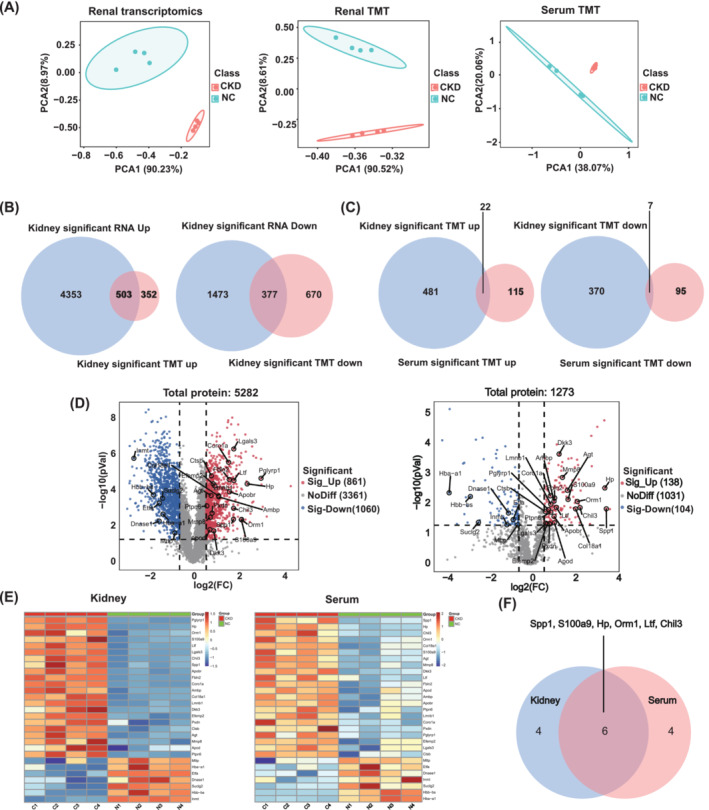
圖2 CKD小鼠腎臟轉(zhuǎn)錄組和蛋白組及血清轉(zhuǎn)錄組分析
3.蛋白組數(shù)據(jù)揭示CKD小鼠肌肉的分子變化
腓腸肌的TMT蛋白質(zhì)組學(xué)PCA分離CKD和NC小鼠的腓腸肌(圖3A)。火山圖顯示,在CKD和NC小鼠之間檢測(cè)到2326種蛋白質(zhì),其中240種和188種蛋白質(zhì)分別顯著上調(diào)和下調(diào)(圖3B)。熱圖代表CKD小鼠腓腸肌中上調(diào)和下調(diào)蛋白中的前30個(gè)DEP(圖3C)。KEGG途徑富集分析表明,包括氧化磷酸化信號(hào)傳導(dǎo)途徑,產(chǎn)熱途徑,ECM-受體相互作用途徑,硫代謝,檸檬酸循環(huán)(TCA循環(huán))和血小板活化途徑發(fā)生了顯著改變(圖3D)。GSEA顯示氧化磷酸化和TCA循環(huán)途徑顯著下調(diào),而ECM-受體相互作用和血小板活化途徑顯著上調(diào)(圖3E)。這些結(jié)果表明,參與上述途徑的蛋白質(zhì)失調(diào)與CKD誘導(dǎo)的肌肉減少癥密切相關(guān)。
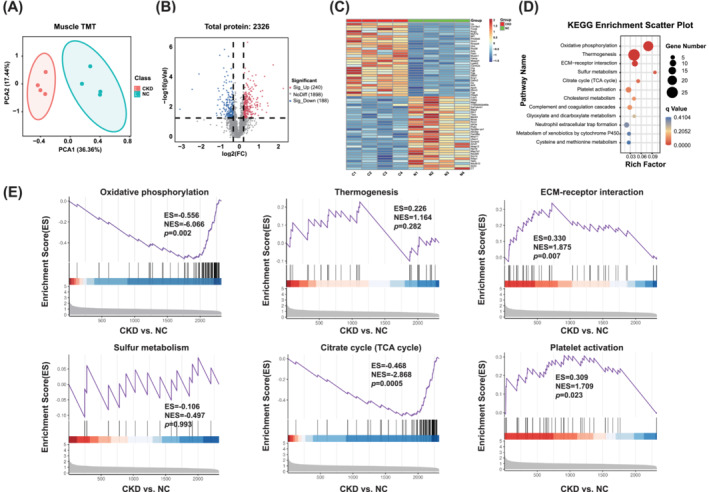
圖3 蛋白組學(xué)數(shù)據(jù)揭示CKD小鼠肌肉分子變化
4.腎臟分泌蛋白與骨骼肌最顯著改變的KEGG通路的蛋白質(zhì)之間的相關(guān)性
假設(shè)腎臟在CKD狀態(tài)下將特定蛋白質(zhì)分泌到血液中,并且這些蛋白質(zhì)可能通過(guò)血液循環(huán)導(dǎo)致骨骼肌損失。對(duì)篩選出的29種蛋白質(zhì)的表達(dá)水平與Scr,BUN,腓腸肌重量和握力之間的相關(guān)性進(jìn)行分析,進(jìn)一步將圖2F中的六種蛋白質(zhì)縮小到五種:Spp1,S100a9,Hp,Orm1和Ltf。對(duì)血清TMT中的這五種蛋白質(zhì)與肌肉TMT的前六個(gè)KEGG途徑中涉及的蛋白質(zhì)進(jìn)行了相關(guān)網(wǎng)絡(luò)分析,以探索這些蛋白質(zhì)對(duì)肌肉功能的潛在影響。血清TMT中S100a9,Hp,Orm1和Ltf的表達(dá)水平與肌肉TMT中氧化磷酸化和產(chǎn)熱途徑中大多數(shù)DEP的變化呈負(fù)相關(guān),但與肌肉TMT中ECM-受體相互作用途徑中的DEP呈正相關(guān)(圖4A)。血清TMT中的Spp1,S100a9,Hp,Orm1和Ltf水平與TCA周期中的大多數(shù)DEP和肌肉TMT中的血小板活化途徑呈正相關(guān)(圖4A)。血清TMT中的S100a9,Hp,Orm1和Ltf與Selenbp1呈負(fù)相關(guān),但與肌肉TMT中硫代謝的Sqor呈正相關(guān)(圖4A)。這些結(jié)果闡明了靶蛋白可能參與的途徑。
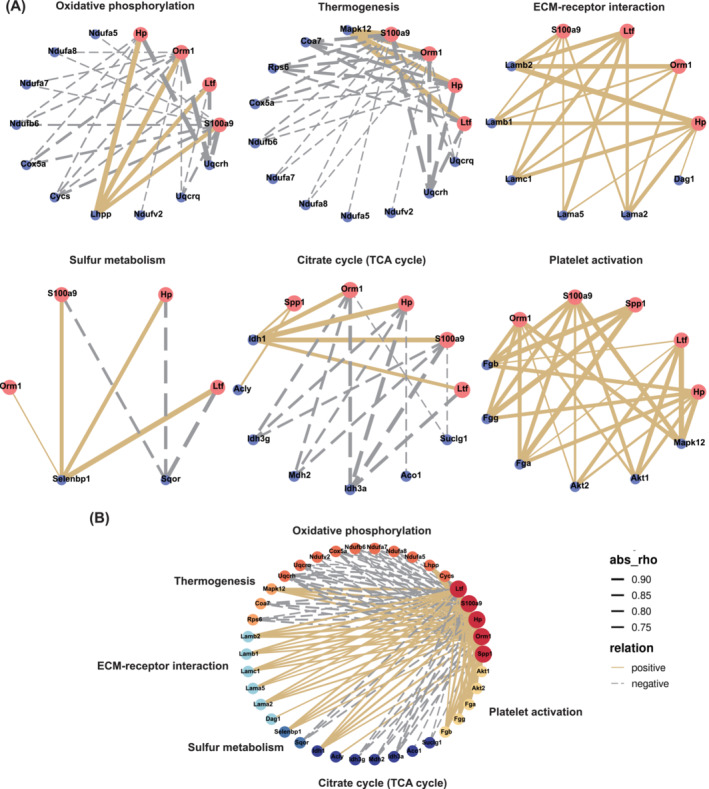
圖4 腎臟分泌蛋白與骨骼肌最顯著改變的KEGG通路的蛋白質(zhì)之間的相關(guān)性網(wǎng)絡(luò)圖
5.Spp1和S100a9重組蛋白對(duì)體外肌管萎縮的影響
經(jīng)過(guò)篩選和文獻(xiàn)綜述,兩種蛋白質(zhì)Spp1和S100a9成為重點(diǎn)目標(biāo)用于研究它們對(duì)C2C12肌管的影響。圖5A顯示了細(xì)胞實(shí)驗(yàn)的流程圖。加入S100a9重組蛋白(100 ng/mL)后,atrogin-1的蛋白水平顯著增加(圖S3A)。然而,加入不同濃度的Spp1重組蛋白后,atrogin-1蛋白水平?jīng)]有觀察到差異(圖5B)。分別添加1000 ng/mL Spp1和S100a9重組蛋白后,murf-1蛋白水平顯著增加(圖5B,圖S3A)。免疫熒光染色表明,高濃度的Spp1或S100a9重組蛋白減少了肌管面積(圖5C,圖S3B)。
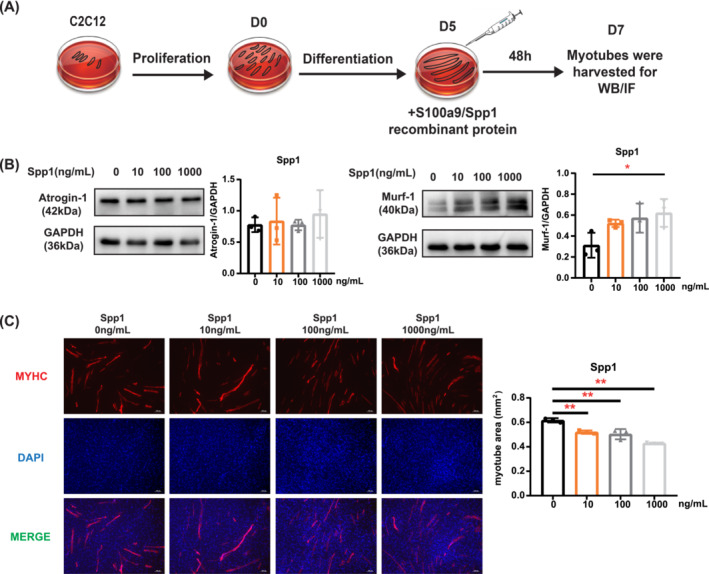
圖5 Spp1重組蛋白對(duì)體外肌管萎縮的影響
6.CKD小鼠模型腎臟、血清和骨骼肌中Spp1的驗(yàn)證分析
CKD小鼠血清Spp1濃度升高(圖6A),這與骨骼肌質(zhì)量呈負(fù)相關(guān)(圖6A)。qRT-PCR表明,CKD小鼠腎臟中Spp1 mRNA水平顯著增加(圖6B),WB和免疫組織化學(xué)進(jìn)一步證實(shí)了這一點(diǎn)(圖6C,D)。同時(shí),免疫組織化學(xué)顯著增加了CKD患者腎臟中Spp1的表達(dá)水平(圖6E)。還使用WB檢查了骨骼肌中Spp1的表達(dá),發(fā)現(xiàn)NC和CKD小鼠之間沒(méi)有差異(圖6C)。因此,腎臟產(chǎn)生的Spp1可能通過(guò)血液循環(huán)影響骨骼肌質(zhì)量。
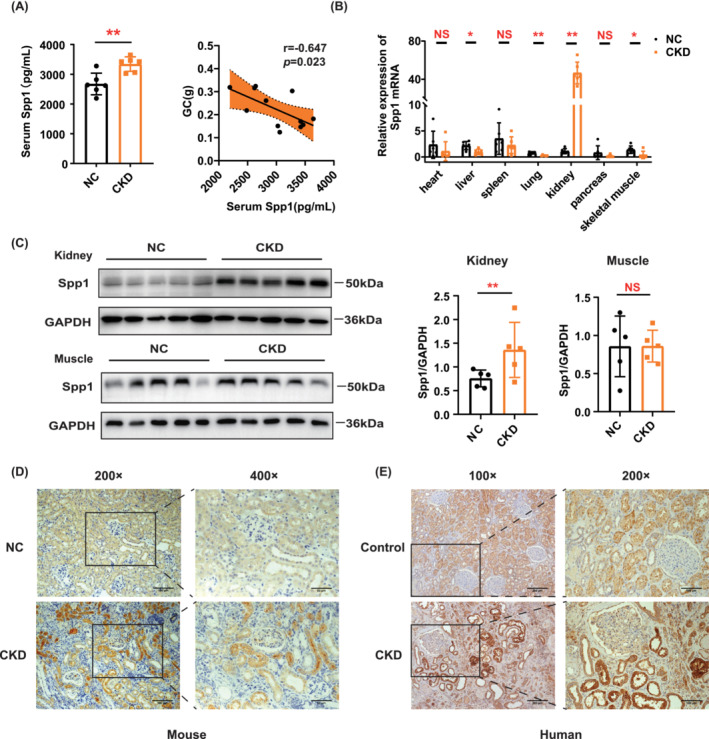
圖6 CKD小鼠模型腎臟、血清和骨骼肌中Spp1的驗(yàn)證分析
7.Spp1的藥理抑制作用可防止實(shí)驗(yàn)性CKD中的肌肉萎縮
在4周的0.2%腺嘌呤飲食后,CKD小鼠每隔一天通過(guò)腹膜內(nèi)注射(100μg/kg)接受一次Spp1中和抗體連續(xù)兩周(圖7A)。用Spp1中和抗體治療可防止CKD小鼠體重減輕(圖7B)。Spp1中和抗體治療2周后,抗Spp1組的握力顯著高于對(duì)照IgG組(圖7C)。同時(shí)抗Spp1組小鼠腓腸肌和脛骨前肌的重量大于對(duì)照IgG組(圖7D)。循環(huán)Spp1的中和降低了CKD小鼠的血液Spp1濃度并輕度改善了血清尿素氮和肌酐水平(圖7E)。與對(duì)照IgG小鼠相比,腓腸肌CSA的定量顯示Spp1中和抗體在終末期時(shí)間點(diǎn)右移(圖7F)。以上說(shuō)明Spp1的藥理學(xué)抑制可防止實(shí)驗(yàn)性CKD中的肌肉萎縮。
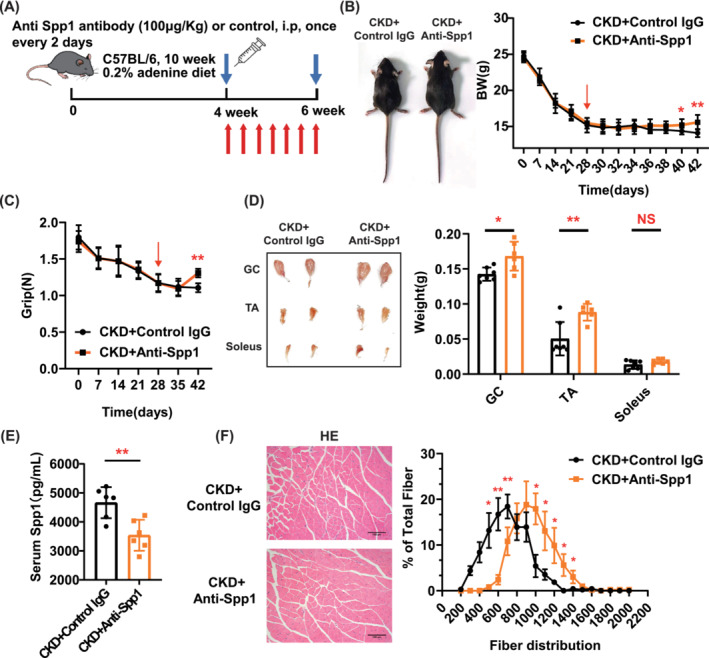
圖7 藥理學(xué)抑制Spp1可預(yù)防實(shí)驗(yàn)性慢性腎臟病(CKD)中的肌肉消耗
8.轉(zhuǎn)錄組鑒定了Spp1藥理抑制的骨骼肌萎縮標(biāo)志物及其驗(yàn)證
為了鑒定CKD小鼠肌肉中受Spp1抑制影響的DEG,作者進(jìn)行了轉(zhuǎn)錄組學(xué)分析,比較CKD小鼠中抗Spp1和對(duì)照IgG處理的GC肌肉。根據(jù)PCA,RNA測(cè)序分離了抗Spp1和對(duì)照IgG組的腓腸肌(圖8A)。火山圖顯示,在這兩組之間檢測(cè)到25個(gè)201個(gè)基因,其中1157個(gè)和760個(gè)基因分別顯著上調(diào)和下調(diào)(圖8B)。熱圖代表了接受Spp1中和抗體治療后CKD小鼠腓腸肌上調(diào)和下調(diào)基因中的前30個(gè)DEG(圖8C)。KEGG途徑富集分析表明,這30條途徑發(fā)生了顯著改變,其中蛋白質(zhì)消化和吸收,胰高血糖素信號(hào)通路,apelin信號(hào)通路,ECM-受體相互作用和細(xì)胞粘附分子的改變最為顯著(圖8D)。同時(shí)驗(yàn)證了用Spp1中和抗體治療后腓腸肌中骨骼肌萎縮標(biāo)志物的表達(dá),發(fā)現(xiàn)Spp1的藥理學(xué)抑制在mRNA和蛋白質(zhì)水平上都改善了肌肉萎縮的標(biāo)志物(atrogin-1和murf-1)(圖8E,F(xiàn))。這些數(shù)據(jù)為阻斷循環(huán)Spp1增加骨骼肌質(zhì)量的機(jī)制提供了線索。
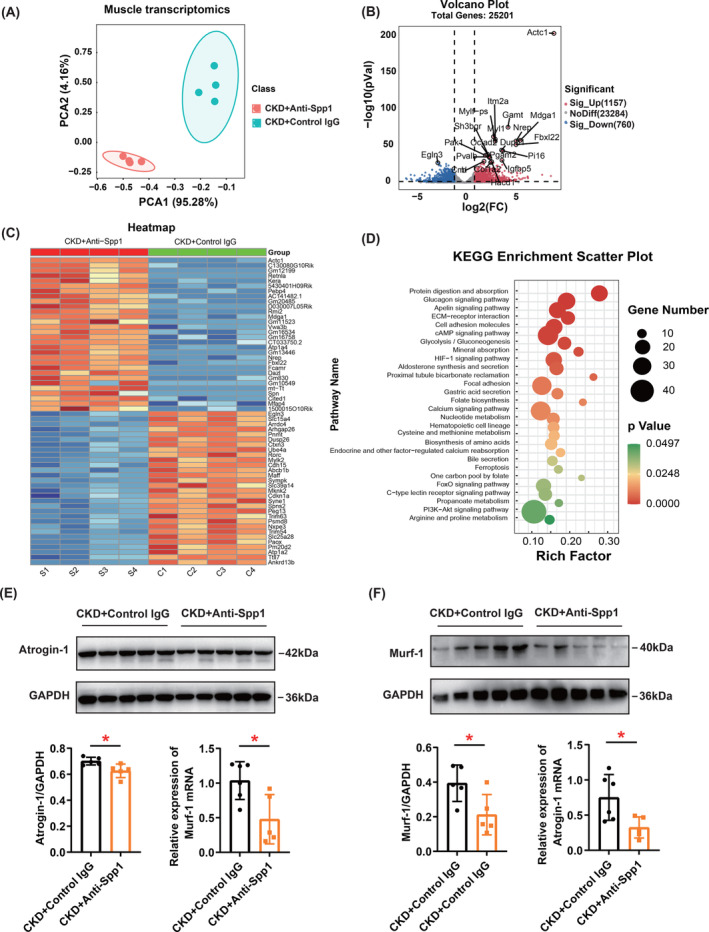
圖8 轉(zhuǎn)錄組分析鑒定出藥理學(xué)抑制Spp1后腓腸肌來(lái)源的差異表達(dá)基因(DEGs),并驗(yàn)證了骨骼肌萎縮標(biāo)志物
總之,本研究結(jié)合了多組學(xué)測(cè)序,從“腎肌肉”軸的角度探索CKD誘導(dǎo)的肌肉減少癥的發(fā)病機(jī)制。通過(guò)多組學(xué)分析、細(xì)胞評(píng)估和動(dòng)物實(shí)驗(yàn),Spp1可能是治療肌肉減少癥的CKD的有前途的目標(biāo)。
滑動(dòng)查看更多:
排版:野凌
審核:三黍生物企宣部


